Fino a poco tempo fa le strategie terapeutiche farmacologiche contro la malattia di Alzheimer (Alzheimer Disease – AD) non avevano mai mostrato efficacia nel modificare la storia naturale della patologia, possedendo unicamente azione sui sintomi, cognitivi e non cognitivi. Da qualche anno, invece, come noto ai neurologi e ai fan della musica indie-pop (“sbadiglio e prendo una boccetta di Aducanumab” cantano i Pinguini Tattici Nucleari in Ricordi), i farmaci biologici contro la β-amiloide (Aβ) sono diventati i protagonisti della ricerca clinica nell’ambito dei disturbi cognitivi, e alcuni di loro, grazie al loro potenziale disease-modifying, sono attualmente disponibili in commercio negli Stati Uniti, in Giappone e in Cina. La loro approvazione ha però suscitato da subito non poche controversie circa l’entità della loro efficacia e dei possibili effetti collaterali.
L’IPOTESI AMILOIDEA
La malattia di Alzheimer risulta ancora oggi complessa e non completamente caratterizzata dal punto di vista patogenetico. La teoria preponderante, nota come teoria della cascata dell’amiloide, vede nell’accumulo di Aβ nel SNC la causa della disfunzione sinaptica, dell’accumulo di grovigli neurofibrillari e della neurodegenerazione tipiche della patologia. Questo modello ha ottenuto particolare successo soprattutto con l’avvento della PET amiloide.
Il ruolo patogenetico dell’Aβ era stato inizialmente attribuito unicamente alla sua conformazione in placche, ma studi successivi hanno ascritto attività metaboliche tossiche ad altre forme di aggregazione meno complesse, come gli oligomeri, le protofibrille, o peptidi tronchi quali l’Aβ piroglutamilata. Le differenti conformazioni di questa proteina espongono epitopi diversi, elemento fondamentale per l’effetto terapeutico degli anticorpi.
ARIA
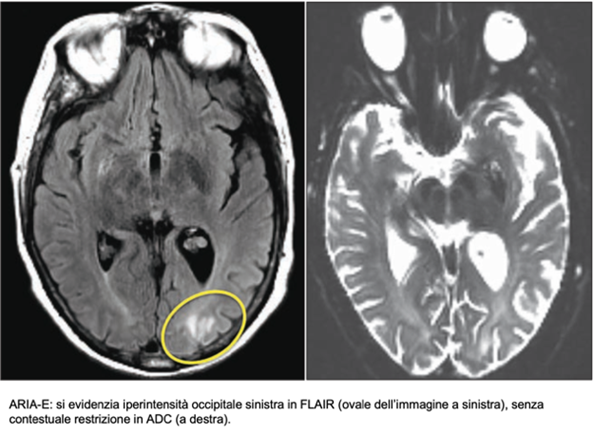
Il termine ARIA (Amyloid-Related Imaging Abnormalities), è stato coniato nel 2010 dall’Alzheimer Association Research Roundtable per indicare alcuni reperti radiologici evidenti in risonanza magnetica dell’encefalo in pazienti in corso di immunoterapie sperimentali per l’AD.
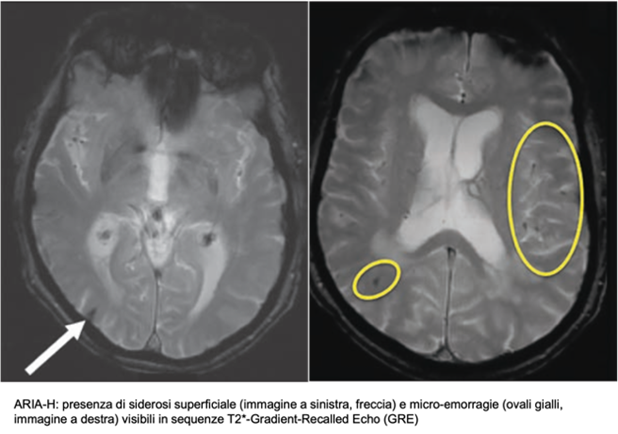
Se ne riconoscono due sottogruppi principali: il primo comprende le ARIA-E, caratterizzate da edema e versamento, e visibili in RM come iperintensità in FLAIR senza concomitante restrizione in DWI. Il secondo gruppo è costituito dalle ARIA-H, micro-emorragie o siderosi superficiale evidenti in sequenze quali T2*-GRE o SWI.
Il principale fattore di rischio per lo sviluppo di ARIA, indipendentemente dal tipo di anticorpo utilizzato, è la condizione di portatore di allele APOE-ε4; sono state inoltre definite associazioni con il dosaggio del farmaco, l’utilizzo concomitante di terapie antitrombotiche (specialmente anticoagulanti) e la presenza di micro-emorragie precedenti all’inizio della terapia.
Le ARIA sono comunemente dei reperti incidentali nella sorveglianza dei pazienti in corso di immunoterapia e decorrono prevalentemente in maniera asintomatica. Una minoranza dei pazienti, tuttavia, mostra sintomi quali cefalea, confusione, deficit visivi, visuo-spaziali o prassici. Non è ancora stato definito quando sia necessaria un’eventuale sospensione della terapia nei casi di ARIA, né il potenziale ruolo terapeutico di farmaci corticosteroidi.
GLI ANTICORPI
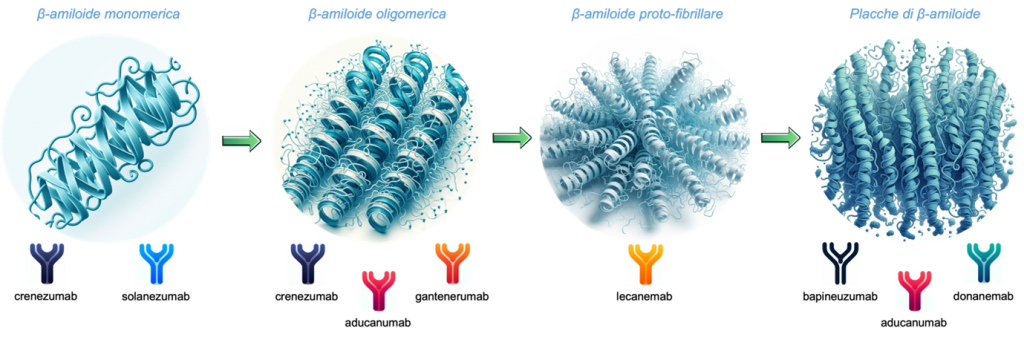
PRIMA GENERAZIONE: Dopo iniziali, sventurati tentativi di immunizzazione attiva (i “vaccini contro l’Alzheimer”) con AN1792 e i conseguenti casi di meningoencefalite asettica subacuta, la ricerca dei primi anni 2000 si è spostata verso la produzione di anticorpi monoclonali, meno attivi immunologicamente. Fra questi, Bapineuzumab era stato disegnato per contrastare le placche di Aβ, ma nel 2012 i trial in cui è stato testato
SECONDA GENERAZIONE:Successivamente, il focus si è spostato verso altre conformazioni di Aβ. Sebbene Solanezumab, che aveva come unico target l’Aβ solubile e monomerica, abbia causato pochi casi di ARIA, nel 2014 e nel 2023 i trial di fase 3 non hanno mostrato né efficacia clinica, né beneficio alla PET. Sia Gantenerumab, sviluppato contro l’Aβ fibrillare insolubile con il fine di attivare la glia e la fagocitosi, che Crenezumab, anticorpo legante diverse forme di Aβ fortemente attivante la fagocitosi, non hanno dimostrato benefici dal punto di vista cognitivo in recenti studi di fase 3.
TERZA GENERAZIONE: Aducanumab è forse il più famoso fra i suoi pari. Il suo target è formato dai residui N-terminali della Aβ, con avidità maggiore per i siti ricchi di epitopi, ossia le placche, dove richiama la microglia e causa fagocitosi. Due celebri studi di fase 3 dal design identico e dalla storia travagliata (fra stop prematuri e partecipanti aggiunti all’ultimo momento), chiamati EMERGE ed ENGAGE, hanno ottenuto risultati contrastanti: il primo ha dimostrato una riduzione della progressione clinica del 22% nei pazienti sottoposti ad Aducanumab 10 mg/kg rispetto al placebo; il secondo, invece, non ha dimostrato alcuna differenza nelle due popolazioni. Gli unici risultati comuni sono stati l’effetto positivo sulla PET amiloide e la percentuale di incidenza di casi di ARIA (35% circa di ARIA-E e 20% circa di ARIA-H; 20% circa di casi sintomatici). A fronte di tutto questo, dopo accesi dibattiti, il 7 giugno 2021 l’FDA ha approvato tramite procedura accelerata Aducanumab per il trattamento di MCI e demenza lieve sulla base del beneficio dimostrato alla PET (un biomarcatore surrogato).
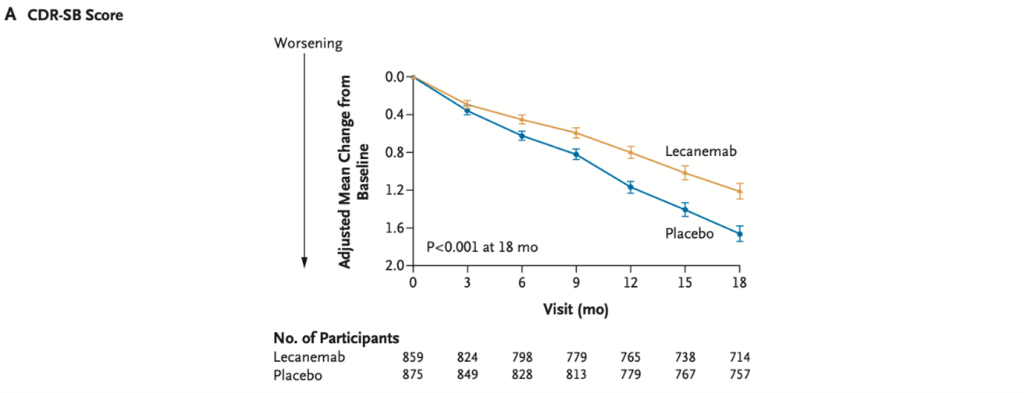
Lecanemab lega gli aggregati solubili di Aβ, specialmente le protofibrille, causandone la fagocitosi astrocitaria e prevenendo la morte neuronale amiloide-indotta. Lo studio di fase 3 CLARITY AD, basato sulla somministrazione di 10 mg/kg di Lecanemab ev ogni 2 settimane per 18 mesi, ha dimostrato una riduzione significativa della progressione del declino cognitivo. Infatti la differenza rispetto alla coorte dei placebo era di -0.45 punti alla Clinical Dementia Rating – Sum of Boxes (uno score per la valutazione del decadimento cognitivo i cui punteggi spaziano da 0 a 18, dove punteggi più alti indicano compromissione maggiore); inoltre, tutti gli end-points secondari, radiologici e clinici, sono stati raggiunti. I casi di ARIA-E ed ARIA-H sono stati, rispettivamente, il 12,6% e 17.3%. Sulla base di questi dati incoraggianti, il 6 gennaio 2023 l’FDA ha approvato l’uso di Lecanemab per il trattamento di MCI e AD lieve. I risultati si sono rivelati talmente promettenti che Biogen, l’azienda produttrice di entrambi gli anticorpi in commercio, ha recentemente deciso di riallocare le risorse economiche in favore delle ricerche in corso su Lecanemab (ad esempio, AHEAD3-4/5 ne studierà gli effetti su individui cognitivamente integri con elevato carico di amiloide alla PET) ed interrompendo sviluppo e commercializzazione di Aducanumab.
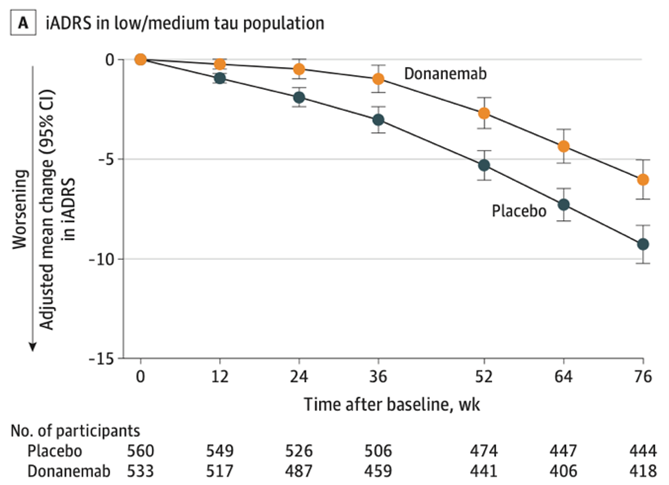
Donanemab, invece, lega una forma di Aβ tronca e piroglutamilata presente unicamente nelle placche stabili e considerata particolarmente tossica, e attiva la microglia. Nello studio di fase 3, TRAILBLAZER-ALZ 2, sono stati reclutati pazienti in base all’accumulo in PET non solo di Aβ, ma anche di proteina tau. Il risultato è stato un rallentamento del declino cognitivo del 35% e del declino funzionale del 40% rispetto al placebo. Le percentuali di ARIA-E ed ARIA-H erano del 24% e del 31%. Dopo un rifiuto da parte dell’FDA ad un’approvazione in via accelerata, è in corso una revisione per l’approvazione in via tradizionale, richiesta dall’azienda produttrice Eli Lilly e attesa entro la prima metà del 2024.
SVILUPPI FUTURI
Al momento, diversi agenti terapeutici sono in fase di studio.Trontinemab, lo chauffeur di gantenerumab attualmente in fase 1, è stato progettato per aumentare la penetrazione attraverso la barriera emato-encefalica utilizzando il trasportatore della transferrina.Remternetug, un analogo potenziato di Donanemab, in fase 1 ha dimostrato di convertire la PET amiloide da positiva in negativa in 3 mesi; è in corso un trial di fase 3, TRAILRUNNER-ALZ1, che contempla inoltre la sua somministrazione per via sottocutanea.
CONTROVERSIE
I risultati degli studi citati hanno paradossalmente rinvigorito sia le posizioni dei promotori della teoria della cascata amiloide, sia quelle degli oppositori. La controparte scettica sostiene che il vantaggio dimostrato, benché significativo dal punto di vista statistico, non si traduca in un effettivo e tangibile beneficio clinico da parte di pazienti e caregivers, e che, anzi, nel lungo termine le curve rappresentanti il declino cognitivo nei trattati e nei controlli sembrerebbero convergere, in contrasto con la definizione di disease-modifying (le risposte definitive saranno disponibili solo attraverso gli studi di Open Label Extension, come quelli su Lecanemab attualmente in corso). Anche qualora venisse dimostrato, tale fenomeno potrebbe essere comunque giustificato dal tempismo d’azione non ottimale: iniziare una terapia di 18 mesi con un declino cognitivo già evidente significa essere tardivi rispetto a un contesto di accumulo di amiloide risalente a decenni prima; d’altra parte, curare sulla sola base di reperti PET (obiettivo del già citato AHEAD 3-4/5) pone diversi problemi etici circa l’esposizione di individui asintomatici a stress e disagi psicologici non quantificabili. Andando oltre i concetti più speculativi, occorre evidenziare che i sottogruppi arruolati negli studi non sono rappresentativi dell’intera popolazione, non includono diverse etnie e hanno mostrato benefici inferiori e più effetti collaterali nelle popolazioni maggiormente vulnerabili, quali ad esempio i portatori di allele ApoE ε4. Da ultimo, nel contesto in cui versa il Sistema Sanitario Nazionale e qualora questi farmaci venissero approvati nel nostro Paese, risulterà fondamentale affinare i criteri di selezione per i pazienti (o pre-pazienti) candidabili a questo tipo di terapia mantenendo una sostenibilità dal punto di vista economico.
CONCLUSIONI
Gli anticorpi monoclonali contro la β-amiloide sono attualmente la linea principale della ricerca terapeutica sull’AD e hanno introdotto dopo circa venti anni nuove molecole per la cura di questa patologia. Per essere confermata, la loro efficacia necessita del risultato dei numerosi studi in corso, e qualora ciò non avvenisse si otterrebbe comunque un dato importante per rivalutare le ipotesi patogenetiche della malattia. Qualunque risposta attenderà il futuro, quello che è necessario fare è adattare il Sistema Sanitario al cambiamento e tenerlo pronto ad accogliere nuovi farmaci costosi attivando percorsi di cura selezionati per pazienti che ne possano beneficiare al meglio e con il minor rischio di effetti collaterali. Insomma, per quanto probabilmente non prenderemo “boccette di Aducanumab”, sicuramente non lo faremo “sbadigliando”!
Giovanni Isgrò
Università degli Studi di Milano-Bicocca, Milano; Neurologia, IRCCS San Gerardo dei Tintori, Monza
BIBLIOGRAFIA
- Rabinovici GD, La Joie R. Amyloid-Targeting Monoclonal Antibodies for Alzheimer Disease. JAMA. 2023 Aug 8;330(6):507-509. doi: 10.1001/jama.2023.11703. PMID: 37459124.
- Yadollahikhales G, Rojas JC. Anti-Amyloid Immunotherapies for Alzheimer’s Disease: A 2023 Clinical Update. Neurotherapeutics. 2023 Jul;20(4):914-931. doi: 10.1007/s13311-023-01405-0. Epub 2023 Jul 25. PMID: 37490245; PMCID: PMC10457266.
- Perneczky R, Jessen F, Grimmer T, Levin J, Flöel A, Peters O, Froelich L. Anti-amyloid antibody therapies in Alzheimer’s disease. Brain. 2023 Mar 1;146(3):842-849. doi: 10.1093/brain/awad005. PMID: 36655336.
- Roytman M, Mashriqi F, Al-Tawil K, Schulz PE, Zaharchuk G, Benzinger TLS, Franceschi AM. Amyloid-Related Imaging Abnormalities: An Update. AJR Am J Roentgenol. 2023 Apr;220(4):562-574. doi: 10.2214/AJR.22.28461. Epub 2022 Nov 2. PMID: 36321981.
- van Dyck CH et al., Lecanemab in Early Alzheimer’s Disease. N Engl J Med. 2023 Jan 5;388(1):9-21. doi: 10.1056/NEJMoa2212948. Epub 2022 Nov 29. PMID: 36449413.
- Biogen to Realign Resources for Alzheimer’s Disease Franchise – January 31, 2024. https://investors.biogen.com/news-releases/news-release-details/biogen-realign-resources-alzheimers-disease-franchise
- Sims JR et al., Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial. JAMA. 2023 Aug 8;330(6):512-527. doi: 10.1001/jama.2023.13239. PMID: 37459141; PMCID: PMC10352931.
- Kepp KP, Robakis NK, Høilund-Carlsen PF, Sensi SL, Vissel B. The amyloid cascade hypothesis: an updated critical review. Brain. 2023 Oct 3;146(10):3969-3990. doi: 10.1093/brain/awad159. PMID: 37183523.