Commento all’articolo “Impaired mitochondrial respiration in REM-Sleep behavior disorder: a biomarker of Parkinson’s disease?” (Ongari et al., Movement Disorders, 2023)
Il ruolo delle disfunzioni mitocondriali nella progressione del disturbo comportamentale del sonno REM verso il Parkinson
La malattia di Parkinson (PD) è una delle patologie neurodegenerative più comuni, caratterizzata da una progressiva perdita di neuroni dopaminergici. Oltre ai sintomi motori, come bradicinesia, tremore e rigidità, la fase prodromica della malattia è contraddistinta da manifestazioni non motorie, tra cui il disturbo comportamentale del sonno REM (RBD). Studi recenti hanno dimostrato che l’RBD idiopatico (iRBD) rappresenta uno dei più affidabili predittori di sinucleinopatie, come la malattia di Parkinson, con un rischio di progressione fino al 90% a 14 anni.
Tra i numerosi meccanismi patogenetici proposti per spiegare questa associazione, il ruolo dei mitocondri ricopre un ruolo centrale. I mitocondri non solo rappresentano le centrali energetiche delle cellule, ma sono anche implicati nel controllo dello stress ossidativo e nell’apoptosi, processi chiave nella neurodegenerazione.
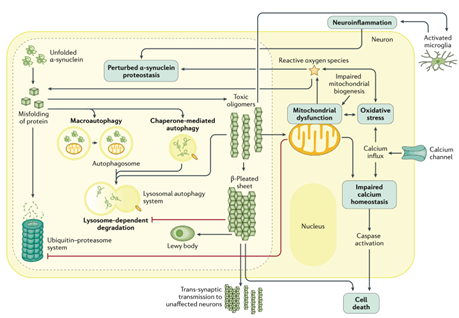
Disturbo comportamentale del sonno REM: una finestra sulla malattia di Parkinson
L’RBD è una parasonnia caratterizzata dalla perdita dell’atonia muscolare durante la fase REM del sonno. I pazienti possono presentare movimenti bruschi e vocalizzazioni legati a sogni vividi, spesso con scarsa consapevolezza degli eventi notturni. Il riconoscimento precoce dell’RBD può rappresentare un’opportunità unica per individuare i primi segni di neurodegenerazione. Le attuali evidenze neurofisiologiche e cliniche suggeriscono che l’RBD sia legato alla degenerazione del nucleo subceruleo e del nucleo peduncolo-pontino, entrambi cruciali per l’induzione dell’atonia REM. Questi nuclei ricevono afferenze colinergiche, gabaergiche e glicinergiche, e la loro disfunzione contribuisce al quadro clinico caratteristico.
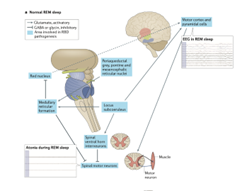
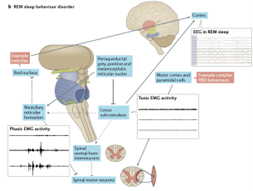
Mitocondri e neurodegenerazione: le evidenze scientifiche
I mitocondri giocano un ruolo cruciale nella fisiopatologia della malattia di Parkinson e nei suoi sintomi prodromici. La prima evidenza di un coinvolgimento mitocondriale nella malattia risale al 1990, quando Schapira et al. hanno dimostrato una ridotta attività del complesso I della catena di trasporto elettronico nei neuroni della substantia nigra dei pazienti con malattia di Parkinson 1. Successivamente, altri studi hanno ampliato questa osservazione. Nel 2013, un’analisi post-mortem ha evidenziato disfunzioni mitocondriali nei neuroni del nucleo peduncolo-pontino, un’area chiave per la regolazione del sonno REM, in pazienti affetti da malattia di Parkinson. Tali disfunzioni comprendevano alterazioni nella quantità e nella qualità delle subunità proteiche dei complessi mitocondriali, suggerendo un possibile legame con la perdita di regolazione muscolare osservata nell’RBD2.
Più recentemente, studi su fibroblasti periferici e cellule mononucleate del sangue hanno confermato l’esistenza di disfunzioni mitocondriali nei pazienti con iRBD e malattia di Parkinson. Per esempio, Smith et al. (2018) hanno dimostrato che i monociti dei pazienti con malattia di Parkinson hanno una concentrazione inferiore di mitocondri, vivono principalmente di glicolisi anaerobia e mostrano una ridotta attività enzimatica della superossido dismutasi, cui consegue un’aumentata produzione di specie reattive all’ossigeno (ROS)3.
Lo studio di Ongari et al. (2023): nuove prospettive
Ongari et al. hanno analizzato la funzione mitocondriale nei fibroblasti di pazienti con iRBD, pazienti RBD-PD e controlli sani. I risultati principali dello studio sono di seguito riportati:
1. Alterazioni bioenergetiche nei fibroblasti
In condizioni basali, i fibroblasti dei pazienti iRBD non mostravano differenze significative nella respirazione mitocondriale rispetto ai controlli. Tuttavia, quando sottoposti a una maggiore domanda energetica, si osservava una riduzione significativa della capacità respiratoria massimale e della riserva energetica. Nei pazienti RBD-PD, queste alterazioni erano ancora più marcate, con una significativa diminuzione del consumo di ossigeno legato alla produzione di ATP .
2. Riduzione delle proteine mitocondriali
Nei pazienti RBD-PD, l’analisi western blot ha evidenziato una significativa riduzione dei livelli di proteine nei complessi III e V della catena di trasporto degli elettroni, implicando un possibile ruolo di questi complessi nella disfunzione respiratoria osservata. Nei pazienti iRBD, invece, le alterazioni erano meno evidenti .
3. Alterazioni nella morfologia mitocondriale
Le immagini ottenute alla microscopia confocale hanno mostrato una frammentazione diffusa della rete mitocondriale nei pazienti RBD-PD. Nei pazienti iRBD, la rete mitocondriale appariva meno compromessa, ma comunque con una complessità ridotta rispetto ai controlli.
Discussione
I risultati suggeriscono che le disfunzioni mitocondriali nei pazienti con iRBD rappresentano una fase iniziale di un processo che progredisce con il peggioramento della patologia e la transizione verso la malattia di Parkinson. La riduzione della capacità respiratoria e la frammentazione mitocondriale nei pazienti RBD-PD sembrano correlarsi con alterazioni nei complessi della catena respiratoria, aumentando la produzione di ROS e il danno ossidativo. Questi cambiamenti potrebbero spiegare la progressiva degenerazione dei neuroni dopaminergici nella substantia nigra, tipica della malattia di Parkinson. La capacità dei fibroblasti di iRBD di mantenere una respirazione basale normale, ma di fallire sotto stress energetico, suggerisce che le alterazioni mitocondriali possano essere compensatorie in questa fase precoce.
In conclusione, le alterazioni mitocondriali rappresentano un tassello cruciale nella comprensione del legame tra iRBD e malattia di Parkinson. Studi futuri dovranno concentrarsi sull’identificazione di ulteriori biomarcatori precoci e sull’applicazione clinica di queste scoperte. Nel frattempo, il riconoscimento precoce dell’RBD e l’analisi delle funzioni bioenergetiche mitocondriali offrono una strada promettente per la prevenzione e il trattamento della malattia di Parkinson.
References:
- Schapira AHV, Cooper JM, Dexter D, Clark JB, Jenner P, Marsden CD. Mitochondrial complex I deficiency in Parkinson’s disease. J Neurochem 1990;54(3):823–827.
- Pienaar IS, Elson JL, Racca C, Nelson G, Turnbull DM, Morris CM. Mitochondrial abnormality associates with type-specific neuronal loss and cell morphology changes in the pedunculopontine nucleus in Parkinson disease. Am J Pathol 2013;183(6):1826–1840.
- Smith AM, Depp C, Ryan BJ, et al. Mitochondrial dysfunction and increased glycolysis in prodromal and early Parkinson’s blood cells. Mov Disord 2018;33(10):1580–1590.
Simone Aloisio
AOU Luigi Vanvitelli
Aloisiosimone10@gmail.com