L’Atrofia muscolare bulbo-spinale (SBMA), nota anche come Malattia di Kennedy, è una patologia dovuta ad un’espansione, superiore alle 37 ripetizioni, della tripletta CAG nel gene che codifica per il recettore degli androgeni. Si tratta di una patologia neurodegenerativa che porta a progressiva atrofia muscolare ed ipostenia in sede bulbare e agli arti, associata a ginecomastia, alterazioni metaboliche e tremori. I sintomi esordiscono solitamente in modo graduale e simmetrico con inizio a livello degli arti inferiori e a livello bulbare, anche se esistono quadri meno frequenti ad esordio monomelico e agli arti superiori. Clinicamente sono presenti sintomi da coinvolgimento del II motoneurone e il quadro EMG è tipicamente neurogeno.
Nel corso dell’ultimo decennio l’origine neurogena primaria del conseguente danno muscolare ha iniziato a vacillare, mentre sempre più evidenze sono emerse a favore di un primario e predominante coinvolgimento muscolare.
I principali dati a favore di tale ipotesi comprendono:
- Dati istopatologici a livello della biopsia muscolare di modelli murini è stato riportato un mix di alterazioni neurogene e muscolari, le quali sono state osservate nei preparati istologici muscolari di topi knock-in per SBMA. In tali cavie le alterazioni muscolari sono state messe in evidenza prima rispetto alla comparsa di danno neurogeno.
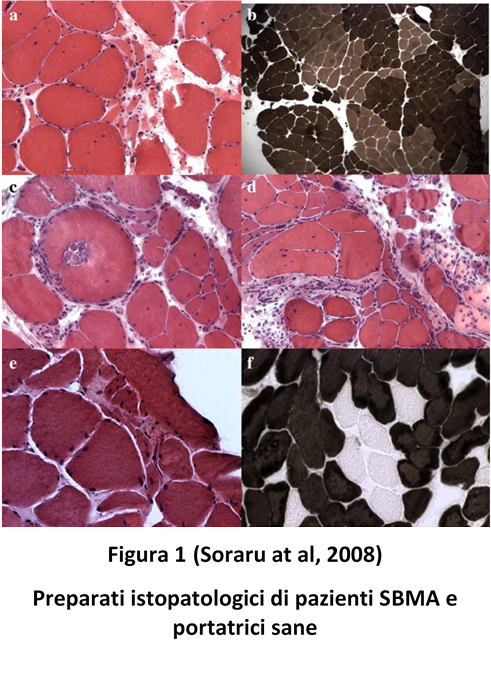
Anche nell’uomo, come evidenziato dal lavoro di Sorarù del 2008, si osservano alterazioni in senso miopatico, con fibre piccole, a volte disperse a volte raggruppate, nuclei clusterizzati, fibre necrotiche, oltre che segni di denervazione, sia in pazienti SBMA (Figura 1A,B,C,D), sia in portatrici sane (Figura 1E,F);
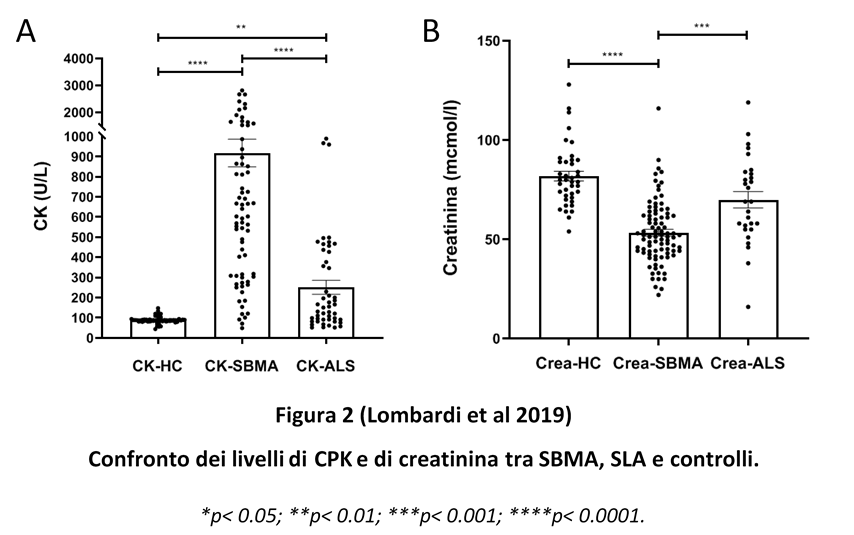
- Biomarcatori à i principali biomarcatori muscolari che avvalorano l’ipotesi dell’origine muscolare sono rappresentati dalla CPK e dalla creatinina (rispettivamente Figura 2A e 2B), i quali sono rispettivamente nettamente aumentati e nettamente ridotti nella SBMA, non solo rispetto al normale, ma anche in confronto ad altre patologie motoneuronali (si veda lavoro pubblicato su Neurology di Lombardi et al.). Inoltre, da notare, la presenza di livelli di neurofilamenti (sia pesanti sia leggeri) nel range del normale nei soggetti con SBMA, rispetto a quanto fino ad ora riscontrato nei soggetti affetti da malattie del motoneurone, in cui, invece, sono nettamente aumentati, come evidenziato dal paper di Lombardi et al del 2019 pubblicato su JNNP. E persino nelle neuropatie, come ad es. nelle CMT, risultano incrementati.
- Neuroimaging alla RM muscolo si è evidenziato un pattern tipicamente muscolare, caratterizzato da infiltrazione adiposa intra-muscolare, come avviene in molte miopatie.
Come mai si avrebbe danno muscolare?
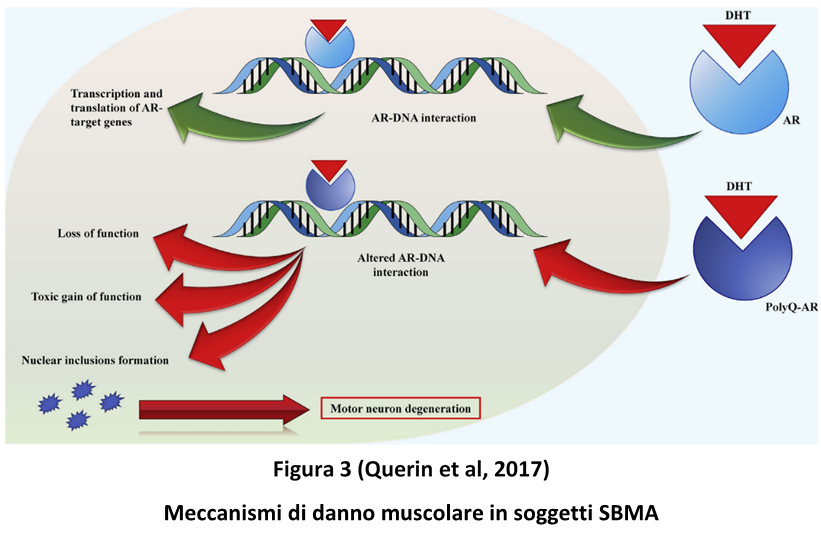
Nella review di Querin G et al. del 2017 viene ben spiegato il ruolo trofico che gli androgeni svolgono sulle fibre muscolari mediante l’azione sui recettori AR; interessante notare come tali recettori siano maggiormente concentrati nelle cellule satelliti muscolari, le quali, quindi, sono i principali bersagli della tossicità dei poli-Q. Mentre in soggetti normali il testosterone adempie ad un ruolo trofico sul muscolo, nei soggetti con SBMA, invece, induce un’azione tossica sulle cellule satelliti, determinando danno muscolare. L’AR mutato provoca: deregolazione della trascrizione genica muscolare, l’alterazione dello splicing dell’RNA (Figura 3).
Il danno neurogeno nella SBMA potrebbe essere anche secondario al danno del muscolo e delle cellule gliali. Infatti tali cellule producono fattori trofici e forniscono supporto ai secondi neuroni di moto e una loro mancanza potrebbe dare neurodegenerazione.
Autore:
dott. Alessandro Bombaci – Università degli Studi di Torino
Referenze:
- Lombardi V, Bombaci A, Zampedri L, et al. Plasma pNfH levels differentiate SBMA from ALS. J Neurol Neurosurg Psychiatry. October 2019. doi:10.1136/jnnp-2019-320624
- Lombardi V, Querin G, Ziff OJ et al. Neuron and muscle biomarkers for SBMA. Neurology 2019;92:1-7. doi:10.1212/WNL.0000000000007097
- Klickovic U, Zampedri L, Sinclair CDJ, et al. Skeletal muscle MRI differentiates SBMA and ALS and correlates with disease severity. Neurology. 2019;93(9):e895-e907. doi:10.1212/WNL.0000000000008009
- Querin G, Sorarù G, Pradat PF. Kennedy disease (X-linked recessive bulbospinal neuronopathy): A comprehensive review from pathophysiology to therapy. Rev Neurol (Paris). 2017;173(5):326-337. doi:10.1016/j.neurol.2017.03.019