I gliomi sono i tumori intra-assiali primitivi più frequenti del sistema nervoso centrale nell’adulto, con incidenza annua complessiva di circa 5-6 nuovi casi su 100.000 abitanti nelle popolazioni europea e statunitense. Originariamente venivano classificati sulla base della somiglianza istopatologica tra le cellule neoplastiche e il citotipo originario presunto, ad esempio precursore astrocitario od oligodendrocitario. Con l’avanzamento delle tecniche di biologia molecolare, è stato possibile identificare mutazioni chiave dell’oncogenesi dei gliomi: in particolare, la mutazione del gene codificante l’isocitrato deidrogenasi (IDH1 e meno frequentemente IDH2) si riscontra nella maggior parte dei gliomi di basso grado (low grade gliomas o LGG) ed è associata a miglior prognosi, rispetto ai gliomi IDH-wildtype. Tra i gliomi IDH-mutati, quelli recanti la delezione dei bracci cromosomici 1p e 19q sono associati al fenotipo oligodendrogliale e maggiore chemiosensibilità. La classificazione WHO 2016 dei tumori del sistema nervoso centrale ha dunque introdotto il concetto di “classificazione isto-molecolare”, catalogando i gliomi IDH-mutati e 1p/19q non codeleti nella categoria degli astrocitomi e gli IDH-mutati e 1p/19q codeleti in quella degli oligodendrogliomi. Tale classificazione aveva già introdotto il concetto secondo cui “il genotipo scavalca il fenotipo”, con esso intendendo che, in caso di discordanza nel processo di individuazione del tipo di glioma, il primo prevale sul secondo. Il glioma più frequente dell’adulto è il glioblastoma (GBM, grado IV), che la classificazione WHO 2016 veniva suddiviso in IDH-mutato o secondario (10%), in quanto derivato da un glioma di basso grado, e IDH-wildtype (90%) o “de novo”.
La nuova classificazione WHO 2021 ha introdotto diversi cambiamenti rispetto alla precedente. In primis, il sistema di grading attuale prevede l’impiego di numeri arabi, al posto di numeri romani, similmente al grading impiegato per i tumori non originanti dal SNC. In secondo luogo, è stato introdotto il concetto di grading “within tumor-type” (“intra-tipo tumorale”), che implica la possibilità di attribuire diversi gradi istopatologici per un determinato tipo di tumore. Ciò rappresenta un cambiamento rispetto alla classificazione WHO 2016, in cui la nomenclatura di molti tumori racchiudeva in sé anche il grado stesso, come ad esempio l’astrocitoma diffuso, per definizione grado II. Di conseguenza, alcuni termini modificatori sono divenuti ormai obsoleti: il termine “anaplastico” (precedentemente associato al grado III) non è più contemplato nella nomenclatura dei gliomi diffusi. Coerentemente con l’avanzamento delle tecniche di biologia molecolare, la regola secondo cui il genotipo prevale sul fenotipo non solo è stata confermata ai fini dell’individuazione del tipo di tumore, ma addirittura è ora valida anche per l’attribuzione del grado istopatologico in alcuni casi specifici (“grading combinato istopatologico e molecolare”). Inoltre, anche l’epigenomica, in particolare lo studio del “metiloma” tumorale, è entrato a tutti gli effetti nei criteri diagnostici e nella nomenclatura di diversi tumori del sistema nervoso centrale.
E’ necessaria inoltre una chiarificazione in merito ai termini modificatori “NOS” (“non altrimenti specificato”) e NEC (“non classificato altrove”). Il primo indica l’assenza di informazioni diagnostiche necessarie per l’assegnazione di una diagnosi secondo la nomenclatura WHO 2021, oppure la presenza di referti non diagnostici o negativi. Diversamente, il suffisso NEC indica che i test diagnostici necessari sono stati completati con successo, ma le informazioni da essi derivanti non consentono una diagnosi. L’esempio più appropriato è la discordanza tra dati clinici, istopatologici, immunoistochimici o genetico-molecolari. Le diagnosi “NEC” sono tipicamente descrittive e non seguono la nomenclatura ufficiale del sistema WHO.
Attualmente, la distinzione tra LGG e GBM è più netta: la presenza della mutazione di un gene IDH è sufficiente per la diagnosi di LGG ed esclude quella di GBM. Inoltre, la presenza della delezione in omozigosi del gene CDKN2A/B, codificante per gli oncosoppressori p16 e p14ARF, si è rivelata fortemente predittiva di scarsa prognosi nei pazienti affetti da astrocitoma IDH-mutato. Per tale motivo, la presenza di questa alterazione genetica è ora sufficiente per definire un astrocitoma IDH-mutato di grado 4, anche in assenza dei classici segni di aggressività istologica. Invece, per quanto concerne gli astrocitomi IDH-wildtype, la diagnosi di GBM può attualmente essere posta anche in assenza di istopatologia suggestiva, in caso di riscontro di almeno una tra 1) amplificazione del gene codificante per EGFR, 2) mutazione del promotore del gene TERT o 3) compresenza del guadagno di un cromosoma 7 aggiuntivo e della delezione completa del cromosoma 10. Questa entità ricade sotto il nome di GBM definito molecolarmente (“molecularly defined GBM” o “molecular GBM”).
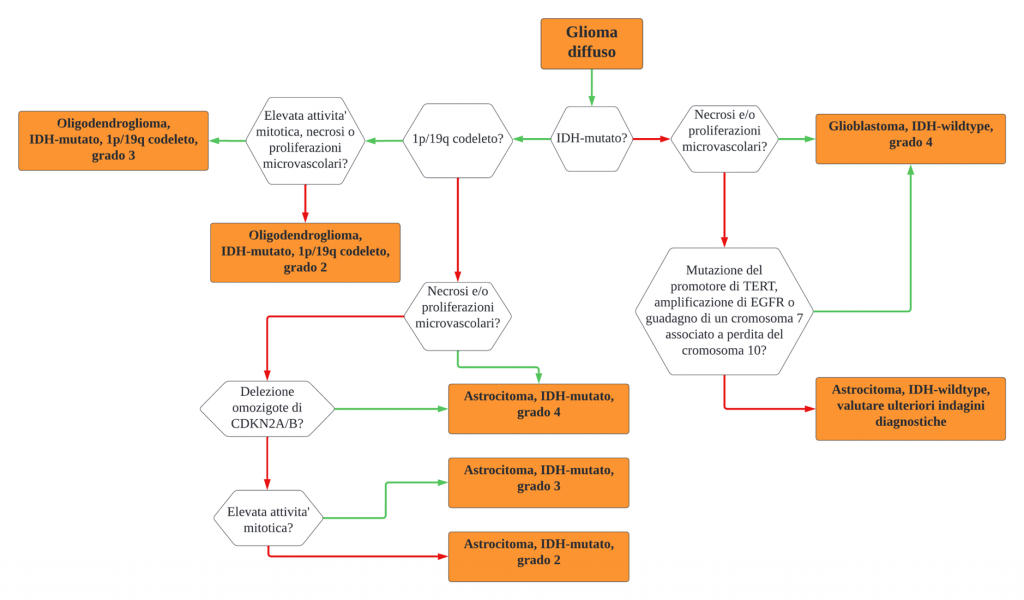
Dunque, la nomenclatura attuale prevede le seguenti categorie di “adult-type diffuse gliomas”: “astrocitoma, IDH-mutato”, “oligodendroglioma, IDH mutato e 1p/19q codeleto” e “glioblastoma, IDH-wildtype” (vedi Figura 1). E’ necessario precisare che tali gliomi colpiscono quasi esclusivamente l’adulto, sebbene raramente possano essere diagnosticati anche nel paziente pediatrico.

Riassumendo (vedi Figura 2), la diagnosi di “astrocitoma, IDH-mutato” di grado 2 è data dal riscontro di neoplasia gliale astrocitaria di aspetto diffusamente infiltrante, istopatologicamente ben differenziata, senza segni indicativi di anaplasia (atipie nucleari), dotata di attività mitotica nulla o scarsa, priva di proliferazioni microvascolari e necrosi.
La diagnosi di “astrocitoma, IDH-mutato” di grado 3 è data dal riscontro di neoplasia gliale astrocitaria di aspetto diffusamente infiltrante, istopatologicamente caratterizzata da segni di anaplasia (atipie nucleari), dotata di evidente attività mitotica, priva di proliferazioni microvascolari e necrosi.
L’ “astrocitoma, IDH-mutato” è definito di grado 4 quando presenta proliferazioni microvascolari o necrosi all’esame istopatologico, oppure delezione del gene CDKN2A/B in omozigosi.
Altre alterazioni genetiche caratteristiche (ma non diagnostiche) dell’ “astrocitoma, IDH-mutato” sono le mutazioni dei geni ATRX e p53.
La diagnosi di oligodendroglioma è data dal riscontro di neoplasia gliale IDH-mutata e 1p/19q codeleta. Il grading dipende dalle stesse caratteristiche istopatologiche discusse per gli astrocitomi IDH-mutati di grado 2-3. Recentemente, è stata riscontrata un’associazione tra la delezione del gene CDKN2A/B in omozigosi ed outcome sfavorevole nei pazienti affetti da oligodendroglioma anaplastico (secondo la vecchia classificazione WHO 2016). Ciononostante, il ruolo e le implicazioni dell’identificazione di tale mutazione negli oligodendrogliomi necessitano di ulteriori studi.
La diagnosi di glioblastoma (GBM), per definizione di grado 4, è data dal riscontro di neoplasia gliale di aspetto diffusamente infiltrante, che presenti almeno una delle seguenti caratteristiche: proliferazioni microvascolari, necrosi, mutazione del promotore del gene TERT, amplificazione del gene EGFR o contemporaneo guadagno di un cromosoma 7 aggiuntivo e delezione completa del cromosoma 10.
Un’ulteriore entità, meno frequente e non dotata di nomenclatura ufficiale WHO 2021, è rappresentata dall’astrocitoma IDH-wildtype, definito dall’assenza delle caratteristiche istopatologiche e molecolari definenti il glioblastoma, di cui sopra. Esso insorge in pazienti mediamente più giovani, è più frequentemente di grado 2 ed è associato con minor frequenza alla delezione in omozigosi di CDKN2A/B, rispetto agli altri gliomi diffusi dell’adulto. A suggerire ulteriormente la necessità di differenziare quest’entità dal GBM vi è la netta differenza di prognosi tra i due tumori, a favore dell’astrocitoma IDH-wildtype.
Una ulteriore novità introdotta dalla classificazione WHO 2021 è la classe di gliomi diffusi di tipo pediatrico (“pediatric-type diffuse gliomas”), che si riscontrano con maggior frequenza nei bambini, meno frequentemente in giovani adulti e, raramente, in età più avanzate. Generalmente possono avere pattern istopatologici diversi o indistinguibili dai gliomi dell’adulto. I gliomi di basso grado di tipo pediatrico sono IDH-wildtype, caratterizzati da decorso indolente e potenzialmente guaribili con sola resezione chirurgica. Da questo deriva l’importanza di identificarli, al fine di risparmiare ai pazienti pediatrici intensi trattamenti chemio-radioterapici, che invece sono di solito indispensabili per la terapia della controparte “adult-type”. Quasi tutti presentano attivazione aberrante della via RAS/MAPK, di solito risultante da alterazioni dei geni BRAF e FGFR1; tuttavia, in alcuni casi possono essere altri i pathways molecolari alterati (es. PI3K/AKT/mTOR). I gliomi di tipo pediatrico di alto grado sono tumori più aggressivi e non completamente curabili, nonostante le molteplici linee di trattamento. Sono contraddistinti da mutazioni risultanti nella sostituzione della lisina in posizione 27 dell’istone H3 isoforma 3 (H3.3) con una metionina (K27M); meno frequentemente, la sostituzione riguarda l’isoforma 1 (H3.1). Questi tumori colpiscono esclusivamente le strutture encefaliche della linea mediana (talamo, tronco encefalico, midollo spinale) e, sebbene siano prevalenti nella popolazione pediatrica, costituiscono all’incirca un terzo dei gliomi diffusi dell’adulto della linea mediana. Un’altra sottocategoria di gliomi di tipo pediatrico di alto grado è quella dei gliomi H3.3 G34-mutati, che sono invece limitati agli emisferi cerebrali.
Infine, i gliomi diffusi di tipo infantile sono tumori di alto grado che tipicamente emergono entro il primo anno di vita o alla nascita. Di solito sono caratterizzati da fusioni oncogeniche coinvolgenti i geni NTRK 1-3, ALK, ROS2 o MET.
In conclusione, i principali cambiamenti introdotti dalla classificazione WHO 2021 comprendono, nell’ambito dei gliomi diffusi, la distinzione più netta tra LGG e GBM, il ruolo fondamentale assunto dai dati genetici ed epigenetici sia nella diagnosi che nel grading, e la distinzione dei gliomi “pediatric-type” da quelli caratteristici della popolazione adulta.
Giulio Sansone (Università degli Studi di Padova)
giuliosansonepd@gmail.com
Bibliografia
- Louis, D. N. et al. cIMPACT‐NOW: a practical summary of diagnostic points from Round 1 updates. Brain Pathol. 29, bpa.12732 (2019).
- Sansone, G., Vivori, N., Vivori, C. et al. Basic premises: searching for new targets and strategies in diffuse gliomas. Clin Transl Imaging 10, 517–534 (2022).
- Tesileanu, C. M. S. et al. Survival of diffuse astrocytic glioma, IDH1/2 wildtype, with molecular features of glioblastoma, WHO grade IV: a confirmation of the cIMPACT-NOW criteria. Neuro. Oncol. 22, 515–523 (2020).
- Komori, T. The molecular framework of pediatric-type diffuse gliomas: shifting toward the revision of the WHO classification of tumors of the central nervous system. Brain Tumor Pathol. 38, 1–3 (2021).
- Capper, D. et al. DNA methylation-based classification of central nervous system tumours. Nature 555, 469–474 (2018).
- The Cancer Genome Atlas Research Network. Comprehensive, Integrative Genomic Analysis of Diffuse Lower-Grade Gliomas. N. Engl. J. Med. 372, 2481–2498 (2015).
- Eckel-Passow, J. E. et al. Glioma Groups Based on 1p/19q, IDH , and TERT Promoter Mutations in Tumors. N. Engl. J. Med. 372, 2499–2508 (2015).
- Zhang, J. et al. Whole-genome sequencing identifies genetic alterations in pediatric low-grade gliomas. Nat. Genet. 45, 602–612 (2013).
- Wu, G. et al. The genomic landscape of diffuse intrinsic pontine glioma and pediatric non-brainstem high-grade glioma. Nat. Genet. 46, 444–450 (2014).
- Berzero, G. et al. IDH -wildtype lower-grade diffuse gliomas: the importance of histological grade and molecular assessment for prognostic stratification. Neuro. Oncol. 23, 955–966 (2021).
- Meyronet, D. et al. Characteristics of H3 K27M-mutant gliomas in adults. Neuro. Oncol. 19, 1127–1134 (2017).
- Appay, R. et al. CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro. Oncol. 21, 1519–1528 (2019).
- Ryall, S. et al. Targeted detection of genetic alterations reveal the prognostic impact of H3K27M and MAPK pathway aberrations in paediatric thalamic glioma. Acta Neuropathol. Commun. 4, 93 (2016).
- Ryall, S., Tabori, U. & Hawkins, C. Pediatric low-grade glioma in the era of molecular diagnostics. Acta Neuropathol. Commun. 8, 30 (2020).
- Guerreiro Stucklin, A. S. et al. Alterations in ALK/ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat. Commun. 10, 4343 (2019).
- Louis, D. N. et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro. Oncol. 23, 1231–1251 (2021).
- Appay, R. et al. CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro. Oncol. 21, 1519–1528 (2019).
- Louis, D. N. et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 131, 803–820 (2016).
- Richardson, T. E., Hatanpaa, K. J. & Walker, J. M. Molecular Characterization of “True” Low-Grade IDH-Wildtype Astrocytomas. J. Neuropathol. Exp. Neurol. 80, 431–435 (2021).
- Horbinski, C., Berger, T., Packer, R. J. & Wen, P. Y. Clinical implications of the 2021 edition of the WHO classification of central nervous system tumours. Nat. Rev. Neurol. 0123456789, (2022).
- Crocetti, E. et al. Epidemiology of glial and non-glial brain tumours in Europe. Eur. J. Cancer 48, 1532–1542 (2012).
- Komori, T. Grading of adult diffuse gliomas according to the 2021 WHO Classification of Tumors of the Central Nervous System. Lab. Investig. 102, 126–133 (2022).
- Low, J. T. et al. Primary brain and other central nervous system tumors in the United States (2014-2018): A sumary of the CBTRUS statistical report for clinicians. Neuro-Oncology Pract. 9, 165–182 (2022).
- Brat, D. J. et al. cIMPACT-NOW update 3: recommended diagnostic criteria for “Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV”. Acta Neuropathol. 136, 805–810 (2018).
- Yan, H. et al. IDH1 and IDH2 Mutations in Gliomas. N. Engl. J. Med. 360, 765–773 (2009).
- Van den Bent, M. J. Interobserver variation of the histopathological diagnosis in clinical trials on glioma: a clinician’s perspective. Acta Neuropathol. 120, 297–304 (2010).
- Makino, Y. et al. Prognostic stratification for IDH-wild-type lower-grade astrocytoma by Sanger sequencing and copy-number alteration analysis with MLPA. Sci. Rep. 11, 14408 (2021).
- Brat, D. J. et al. cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol. 139, 603–608 (2020).