ASPETTI FISIOLOGICI DEL SONNO
La definizione di sonno più accettata è “stato comportamentale caratterizzato da: relativa inattività (rispetto alla veglia), aumento della soglia di risposte alle stimolazioni esterne, rapida reversibilità (che lo differenzia dal coma), recupero dopo privazione (di intensità e non di durata)”. Solo una percentuale di tutti gli animali è stata studiata dal punto di vista del sonno ma tutti quelli studiati dormono; anche nella Drosophila, studiata con un unico millimetrico elettrodo si è registrata un’attività elettrica cerebrale in sonno quasi sovrapponibile a quella umana.
Un correlato descrittivo fondamentale del sonno è l’EEG, fondamentale ausilio nella definizione delle varie fasi. I cicli del sonno sono costituti da due fasi:
- Fase non-REM, che rappresenta il 75% del sonno e a sua volta è suddivisa nei vari stadi N1, N2, N3;
- Fase REM (il restante 25%).
La successione tra queste fasi costituisce un ciclo di sonno. Dalla fase N1 si passa sequenzialmente alle fasi N2 ed N3, per poi tornare di nuovo a N2 e, dopo circa 90-110 minuti in media dall’inizio dell’addormentamento, alla fase REM. In un adulto ci sono circa 4-6 cicli durante un sonno completo.
Tali cicli non si ripetono in modo uguale nel corso della notte. Nella prima metà, infatti, vi è una prevalenza di sonno non-REM con varie fasi N3 (definito sonno ad onde lente), mentre nella seconda parte prevalgono le fasi REM, che diventano di durata più prolungata.
Il grafico che rappresenta il sonno è denominato ipnogramma. La fase N4, costituita da una percentuale di onde lente maggiore al 50%, viene poco menzionata ad oggi, in quanto è stata inglobata nel terzo stadio di sonno non-REM.
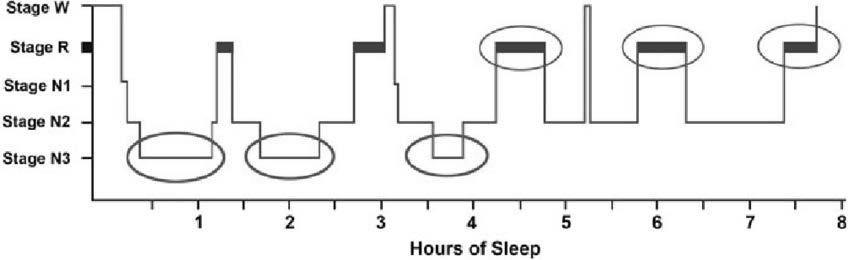
Figura 1 Ipnogramma. SR Pandi Peruma, DW Spencel. Polysomnography: An Overview July 2014 DOI: 10.1007/978-1-4939-1185-1_4
Il sonno è un fenomeno attivo durante il quale i neuroni non si “spengono”, ma cambiano la loro frequenza e modalità di scarica; quale sia la più piccola unità anatomica che dorme (il neurone, gruppi di neuroni, aree) non è ancora noto. Nel gatto, registrando l’attività di ogni singolo neurone, si è visto che ci sono momenti in cui si verifica un’iperpolarizzazione che determina un “down” dell’EEG, un silenzio del potenziale d’azione, seguiti da periodi di attivazioni-depolarizzazione: ciò determina un’alternanza di periodi ON-OFF chiamata oscillazione lenta, che è l’unità funzionale del sonno non REM. I periodi di silenzio dati dall’attivazione sincrona dei gruppi neuronali sono stati confermati in studi sull’uomo con elettrodi intracorticali.
“Modello a due processi” della regolarizzazione del sonno
Secondo questo modello il sonno e la veglia sono due funzioni che vengono affidate a complessi processi che trovano posto all’interno del nostro encefalo: (1) Il processo S (Sleep) detto omeostatico ed il (2) processo C (circadiano).
- Il processo S determina la pressione del sonno, aumenta con la veglia e correla con la sua intensità. Per questo motivo, quando si sta svegli per molte ore, aumenta la profondità delle ore del sonno successivo (e non la sua durata). Dopo una notte insonne, infatti, si dorme lo stesso numero di ore, ma in maniera più profonda e intensa.
- Il processo C è regolato dalla melatonina, ormone derivato dal triptofano che interagisce sui 3 recettori centrali e su uno periferico. È considerato il “direttore d’orchestra” del nostro ritmo biologico che determina anche le differenze interindividuali. La secrezione di melatonina è inibita dalla luce blu durante il giorno.
Il processo C è un circuito di tipo inibitorio che parte dalla luce, agisce sul tratto retino-ipotalamico, sul nucleo soprachiasmatico, sul quale agiscono anche altri stimoli (come i rumori) che portano ad inibire il rilascio di melatonina e quindi a procrastinare l’inizio del sonno. Anche la genetica trova un ruolo in questo processo. Ci sono infatti geni detti “clock” che regolano il processo C modulando l’azione della melatonina sul nucleo soprachiasmatico. I tre sincronizzatori del ritmo sonno-veglia a cui il processo C è sensibile sono: la luce solare, la temperatura corporea (il cui picco è alle 3 di notte circa, quando in generale c’è la massima pressione del sonno, ma tende ad essere più anticipato con l’aumentare dell’età) e l’orologio biologico interno, geneticamente predeterminato.
Il biomarcatore dell’intensità (processo S) del sonno non-REM è lo SWA (slow wave activity), ovvero l’attività lenta in banda theta del sonno N3. Lo SWA è alto durante le prime fasi del sonno, aumenta dopo la privazione di sonno e diminuisce nelle giornate con sonnellini (nap) pomeridiani: la pressione del sonno in queste giornate si affievolisce; pertanto, la notte successiva il sonno sarà meno intenso. L’intensità del sonno è determinata da fattori ancora ignoti. Sono forse fattori solubili? Esperimenti sui cani di trasferimento del liquido cefalorachidiano (CSF) con BDNF (Brain Derived Neurotrophic Factor) hanno dimostrato che nei cani riceventi il CSF con il BDNF aumentava lo SWA. Questo fattore aveva un ruolo causale nell’indurre il sonno, in quanto trasferendo anche anticorpi che neutralizzavano il BDNF, non si verificava tale aumento dello SWA.
Altri esperimenti su topi e uomini sono stati condotti inducendo i soggetti ad eseguire ripetutamente un comando durante il giorno. Nella notte successiva si registrava l’attività corticale in sonno e la sua intensità in termini di SWA con un EEG ad alta densità, molto accurato dal punto di vista spaziale. Questi studi hanno dimostrato come, dopo processi di apprendimento, ci siano aree corticali “allenate”, sottoposte a potenziamento sinaptico che durante il sonno mostrano un aumentano dello SWA. Queste onde lente sono quindi plasticamente coinvolte in processi di adattamento/apprendimento. La pressione del sonno (ovvero la spinta verso l’addormentamento) sarebbe maggiore in queste regioni cerebrali sottoposte a potenziamento sinaptico. Pertanto, il sonno della notte successiva all’allenamento ha la funzione di eliminare il segnale di fondo di tutti gli stimoli ricevuti durante la veglia, facendo emergere l’informazione appresa: è il cosiddetto processo di potatura, prouning, neuronale.
Un marker della forza sinaptica è stato valutato misurando in vivo il numero di sinapsi durante la veglia. Questa componente strutturale aumenta durante la veglia tramite processi di sinaptogenesi. Il prouning avverrebbe invece durante il sonno riducendo le sinapsi create di circa il 2%, consentendo la “liberazione dello spazio”, tipica del sonno. Il sistema della veglia non è determinato, come si pensava un tempo dagli esperimenti di Bremer, dalle afferenze dei nervi cranici, ma risiede nella sostanza reticolare attivante troncoencefalica. È un sistema inibitorio, gabaergico, stabilizzato in maniera complessa da sistemi di neuromodulazione. Una delle ipotesi sulle funzioni del sonno è l’ipotesi sinaptica-omeostatica: durante la veglia, i vari neuromodulatori sono attivi e consentono l’apprendimento.
IL SONNO E IL RITMO SONNO-VEGLIA DAL BAMBINO ALL’ANZIANO
Bambino. Ci sono varie differenze nel sonno del bambino rispetto a quello dell’adulto. Il bambino fino ad un anno dorme circa 16 ore, ma in maniera discontinua, con le fasi più lunghe che durano al massimo 4 ore. I cicli durano in media 50 minuti, a differenza dei 90 degli adulti, e sono 1-2 per sonno. L’EEG nel bimbo è caratterizzato da un’alternanza tra burst (gruppo di onde a comparsa e scomparsa improvvisa distinguibili dall’attività di fondo per frequenza, forma e/o ampiezza; non è necessariamente indice di anormalità e non è sinonimo di parossismo) e intervalli interburst. Possiamo classificarlo in base a numerosi parametri, alcuni riferiti al comportamento del bambino (presenza di occhi aperti o chiusi, mimica facciale, assenza di movimenti) e altri a parametri vegetativi.
Se ne distinguono tre fasi principali:
- sonno attivo, caratterizzato da movimenti oculari rapidi, twitch muscolari, possibile presenza di mimica facciale (sorrisi), che diventerà sonno REM dell’adulto tra i 3 e i 6 mesi;
- sonno quieto, caratterizzata dall’assenza di movimenti oculari, mentre i battiti cardiaci e respiratori sono regolari. Ci sono i burst con alternanza interburst, l’EMG mostra una bassa o scarsa attività, con parametri vegetativi regolari. Questa alternanza in EEG prende il nome di tracciato alternante. Fino alla 37° settimana è prevalente questo sonno quieto; questa fase tra i 3 e i 6 mesi matura come non-REM con le fasi N1, N2, N3;
- sonno intermedio: presenta caratteristiche sia del sonno attivo che del sonno quieto.
Già dai primi mesi si configurano delle figure elettroencefalografiche del sonno: i primi a comparire sono gli spindles, che derivano da attività talamo-corticali, inizialmente asincroni e poi sempre più sincroni. In seguito, compaiono i complessi K, espressione delle fluttuazioni lente a livello corticale. Il sonno intermedio dai 3-6 mesi sparisce completamente e da un tracciato, come detto, alternante si passa alle fasi note N1, N2 (complessi K, spindles), N3 (attività delta).
Il sonno del lattante nei primi mesi di vita è molto frammentato, con frequenti arousal. Fino al 50% è sonno REM e contribuisce, come la veglia, al neurosviluppo e alla formazione delle sinapsi del bambino. Successivamente c’è una progressiva riduzione del tempo totale di sonno (TST), inizialmente di 16 ore (nel neonato), poi di 14 ore (a 6-12 mesi), 11-13 ore (dagli 1 ai 3 anni), fino ad arrivare gradualmente alle 7-8 ore dell’adulto. Il ritmo circadiano inizia a consolidarsi intorno ai 3 mesi. A 12 mesi si dorme circa 14 ore, compresi 1-2 nap pomeridiani.
Nel bambino privato di sonno aumenta la durata del sonno successivo, al contrario che nell’adulto dove aumenta l’intensità/profondità del sonno (in termini di SWA). Dai 3 ai 5 anni scompaiono anche i nap pomeridiani in parallelo con la diminuzione delle ore totali di sonno.
Nell’adolescente il TST cala nei giorni scolastici ma non nei giorni festivi; per questa motivazione è necessario indagare sempre le preferenze personali nei giorni di festa per escludere problematiche relative al cosiddetto “social jetlag”: l’adolescente dal punto di vista del cronotipo tende ad essere più serotino (dormire più tardi la sera e svegliarsi tardi la mattina), tuttavia gli impegni sociali e scolastici impongono routine diverse. Questo determina un disallineamento tra la fisiologia del sonno e lo schema sociale imposto. Di fatti, dal punto di vista cognitivo, bambini e adolescenti sarebbero più attivi nelle ore pomeridiane e non al mattino presto.
Anziano. L’invecchiamento sano comprende disabilità, aspetti cognitivi e soddisfazione del proprio essere. Nell’anziano abbiamo un cambiamento della quantità e della qualità del sonno REM. Le modificazioni del sonno nell’anziano determinano infatti una riduzione del TST con riduzione di N3, aumento di N1 e una conseguente complessiva riduzione dell’efficienza del sonno (SE). Le malattie croniche invalidanti riducono a loro volta SE. La fase REM determina il consolidamento della memoria. Non deve sorprendere quindi che nella malattia di Alzheimer si verifica un’alterazione delle onde ultralente durante il sonno e uno stravolgimento dei ritmi circadiani. Il fenomeno del napping, ovvero l’anticipazione nelle fasi del sonno per gli anziani, è considerato un marker di neurodegenerazione e un fattore di rischio indipendente per malattie neurodegenerative.
Il rischio di demenza, dato da fattori come il diabete, le OSAS o primo tra tutti l’aplotipoE4 che aumenta il rischio di demenza di 4 volte, e in misura maggiore nelle femmine, è aumentato se si associa a difficoltà nel mantenimento del sonno e ad alterazioni del ritmo circadiano, piuttosto che alla durata del sonno. Non è un caso che le OSAS anticipino il mild cognitive impairment (MCI) e la malattia di Alzheimer.
Oreste Marsico
Università degli Studi “Magna Graecia” di Catanzaro
“Centro Regionale Epilessie”, Reggio Calabria
o.marsico@unicz.it
Giorgio Spano
Università degli Studi “Magna Graecia” di Catanzaro
dr.giorgiospano@gmail.com
BIBLIOGRAFIA
- Liguori C, Strambi LF, Plazzi G, Antelmi E, Arnaldi D, Berardelli A, Bonanni E, Di Lorenzo F, Fanfulla F, Faraguna U, Guarnieri BM, Lombardo C, Maestri Tassoni M, Mercui NB, Palagini L, Pizza F, Placidi F, Proserpio P, Provini F, Silvestri R. Corso Sleep Young: “La medicina del sonno nella formazione del giovane neurologo” – Roma 19-20 aprile 2023.
- SR Pandi-Perumal, DW Spence. Polysomnography: An Overview July 2014 DOI: 10.1007/978-1-4939-1185-14
- https://www.uptodate.com/contents/classification-of-sleep-disorders
- https://www.uptodate.com/clinical-presentation-and-diagnosis-of-obstructive-sleep-apnea-in adults