Si è da poco conclusa a Firenze la XVIII edizione del congresso SINDEM. L’evento, dal titolo “Brain Health”: dalla prevenzione alla terapia nella fase precoce della demenza, riflette lo spostamento del focus del mondo delle demenze, sempre più improntato alla prevenzione, e introduce il nuovo concetto di Brain Health.
L’OMS definisce Brain Health come “lo stato di funzionamento cerebrale attraverso i domini cognitivo, sensoriale, sociale-emotivo, comportamentale e motorio, che permette all’individuo di realizzare il proprio pieno potenziale durante il corso della vita, indipendentemente dalla presenza o assenza di disturbi”1. Si tratta di una definizione dinamica, che tiene in considerazione anche aspetti di resilienza, e non si limita all’ambito cognitivo, sebbene con l’età gli aspetti cognitivi rappresentino un determinante cruciale della Brain Health. La prevenzione del decadimento cognitivo è fondamentale per la Brain Health, tenendo tuttavia in considerazione che questo processo dovrebbe iniziare idealmente alla nascita (torneremo più avanti su questo aspetto) e continuare lungo tutto l’arco della vita.
La prevenzione del declino cognitivo
Quando si parla di prevenzione bisogna porsi delle domande fondamentali: a chi è rivolta? Quando effettuarla? E come? Lavori recenti hanno mostrato come la popolazione affetta da malattia di Alzheimer (AD) in forma preclinica sia estremamente numerosa, nonostante questa rappresenti solo una parte delle demenze precliniche. A fronte di una stima di circa 32 milioni di persone con demenza AD e 69 milioni con AD prodromico (mild cognitive impairment, di cui ha parlato in un altro articolo il dott. Salemme), i soggetti con AD preclinico sono circa 315 milioni a livello mondiale2. L’AD preclinico comprende sia soggetti cognitivamente normali (corrispondenti allo stadio 1 della classificazione NIA-AA del 2018), sia soggetti con decadimento cognitivo soggettivo (SCD, stadio 2). Il decadimento cognitivo soggettivo è una condizione in cui il soggetto sente di “funzionare peggio” rispetto al passato in uno o più domini cognitivi, con tuttavia una performance normale ai test neuropsicologici standardizzati per età e scolarità3. Questi soggetti ad oggi non trovano un posto codificato nell’offerta dei nostri sistemi sanitari, trovandosi in una terra di mezzo tra le generiche e spesso insufficienti raccomandazioni dei medici di famiglia, e l’esclusione dai trattamenti proposti dalle memory clinics, pensati per chi ha già un decadimento cognitivo obiettivabile. È in questo spazio che si inserisce la proposta dei Brain Health Services (BHS) che il prof. Frisoni ha presentato nell’ambito della prima sessione scientifica del congresso della SINDEM.
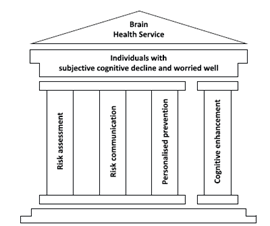
I Brain Health Services per le demenze (dBHS)
Come già dettagliato in una serie di paper del 20214–9, i dBHS sono costituiti da quattro pilastri (Figura 1): stima del rischio di demenza alla luce delle evidenze attualmente disponibili, comunicazione del rischio secondo protocolli standardizzati, riduzione del rischio tramite interventi strutturati multidimensionali personalizzati, e, in futuro, enhancement cognitivo. Questi servizi sono pensati per una popolazione a rischio aumentato di decadimento cognitivo, come gli SCD, che può maggiormente beneficiare di un approccio mirato volto alla riduzione di tale rischio.
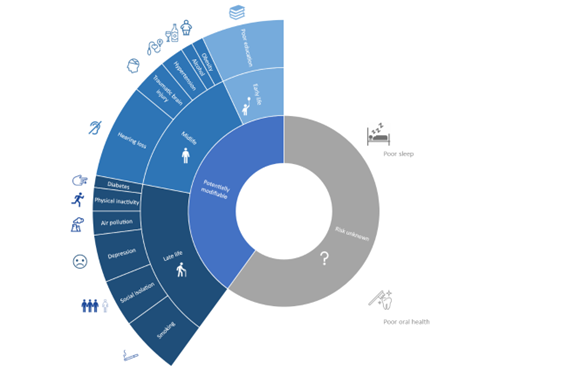
Per quanto riguarda la stima del rischio, questo si basa su una serie di fattori modificabili e non (Figura 2), ciascuno con un diverso peso nel corso della vita. Questi fattori comprendono i 12 individuati dalla Lancet Commission nel 2020 (riportati nella figura sottostante)10, a cui si aggiungono altri fattori come il polimorfismo ε4 dell’APOE, la presenza di biomarker di accumulo di amiloide cerebrale e tau fosforilata, biomarker di neurodegenerazione e il carico di malattia cerebrovascolare sottocorticale. Evidenze crescenti si stanno accumulando inoltre su sonno e igiene orale. Questi fattori sono grossolanamente divisibili in fattori di rischio “vascolare” e fattori di rischio “degenerativi”, nonostante in alcuni casi sia difficile attribuirli all’una o all’altra categoria. Sommati, i fattori di rischio potenzialmente modificabili hanno un peso comparabile, se non superiore, a quelli biologici (come amiloide e tau, che conferiscono singolarmente il rischio maggiore)11. Nell’ambito dei BHS, la stima del rischio passa per la valutazione di tutti questi fattori, oltre che dalla presenza di certe caratteristiche che aumentano la probabilità di progressione dell’SCD, chiamate SCD-plus, comprendenti tra le altre la ricerca di aiuto medico, la conferma del disturbo da parte di un informatore, l’età maggiore di 60 anni3. Sono inoltre disponibili dei modelli (come il CAIDE o il BDSI) che prendono in considerazione alcuni di questi fattori per fornire una stima numerica del rischio.
La comunicazione del rischio prevede quindi l’utilizzo di approcci standardizzati, che possono beneficiare dell’utilizzo di infografiche per tradurre visivamente concetti che possono non essere facilmente accessibili agli utilizzatori dei BHS. A questa fase segue quella del vero e proprio trattamento preventivo, in base al peso relativo dei fattori di rischio. Per esempio, se per un soggetto a basso rischio (sia neurodegenerativo che vascolare) ci si potrà anche solo fermare alla fase di comunicazione, a chi è ad alto rischio verranno proposti interventi preventivi personalizzati multidimensionali.
Interventi multidominio per la prevenzione del declino cognitivo
Un’analisi di questi interventi è stata fornita dal dott. Altomare all’interno della stessa sessione, illustrando le evidenze presenti in letteratura, non sempre concordi. Gli interventi multidominio includono combinazioni variabili di attività fisica, dieta, stimolazione o training cognitivo, socializzazione, controllo dei fattori di rischio cardiovascolare. Non tutti gli studi includono tutti questi domini, mentre alcuni studi ne includono di diversi. Tra gli studi principali (Tabella 1), MAPT e preDIVA non hanno mostrato differenze tra il gruppo di intervento ed i controlli sani in termini cognitivi. Al contrario, lo studio FINGER ha evidenziato un miglioramento in entrambi i gruppi, con un piccolo vantaggio statisticamente significativo per il gruppo di intervento. Analisi successive dei risultati di questi studi hanno mostrato effetti significativi nei partecipanti con CAIDE ≥ 6 e PET-amiloide positiva nel MAPT, un’incidenza quasi dimezzata di demenza in caso di ipertensione non trattata e aderenza al trattamento nel preDIVA, ed effetti significativi nei carrier di APOE ε4 nel FINGER.

Tutto questo giustifica l’adozione di due modelli diversi di riduzione del rischio. Se da un lato ci si può aspettare un miglioramento anche in presenza di generici consigli nella popolazione a basso rischio, per i soggetti ad alto rischio è possibile mettere in atto interventi strutturati come quelli proposti nell’ambito del trial FINGER. Non bisogna però dimenticare che l’effetto atteso è in ogni caso ridotto, e allo stato attuale esiste qualche perplessità sull’opportunità di implementare tali approcci su larga scala.
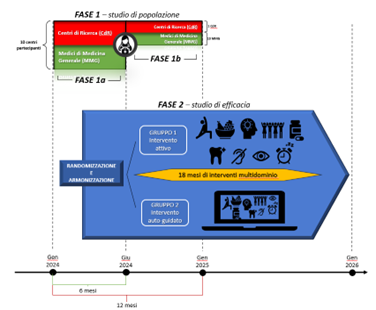
I risultati di questi studi sono ancora lontani dall’essere generalizzabili su larga scala, ed è necessario aumentare le conoscenze e ottenere dati calati nel tessuto socio-culturale proprio di diverse realtà. Con questo intento è nato il network Worldwide FINGERS15, volto ad armonizzare i diversi studi FINGER-like, ciascuno adattato allo specifico contesto culturale del paese in cui è svolto. All’interno di questo network si inserisce lo studio IN TeMPO (Figura 3), uno studio multicentrico italiano promosso dall’Università di Milano-Bicocca e presentato dal dott. Cuffaro nella già citata sessione. Si tratta di uno studio realizzato secondo la metodologia FINGER, innestato nell’ambito del più ampio progetto Age-IT finanziato nell’ambito del PNRR. Rispetto al FINGER originale, è stato esteso il numero di domini includendo anche la revisione farmacologica, il counseling sul sonno e l’igiene orale. Inoltre, è previsto un uso importante di supporti tecnologici innovativi, come devices indossabili, per fornire maggiori dati. Lo studio è attualmente in partenza, e il suo completamento è atteso per il 2026.
Tuttavia, per quanto queste proposte aprano scenari interessanti nell’ambito della prevenzione, non bisogna dimenticare che per ridurre efficacemente il carico dei disturbi cognitivi è necessario agire anche su larga scala tramite interventi di politica sanitaria, volti a ridurre tutti quei fattori che impattano negativamente sulla Brain Health nella popolazione generale, come la povertà, la mancanza di istruzione e la discriminazione razziale, e rientranti nel capitolo della prevenzione “primordiale”. La proposta dei BHS rappresenta per contro un approccio estremamente mirato e complementare di prevenzione secondaria, rivolto ad una specifica popolazione a rischio aumentato di decadimento cognitivo, per la quale bisognerà comunque discutere i prevedibili risvolti in termini di accessibilità e sostenibilità.
Nel secondo articolo di questa serie tratteremo delle prime esperienze pilota in Europa dei BHS, partendo dal contesto internazionale per arrivare alla prima esperienza italiana, che abbiamo recentemente avviato a Monza.
Federico Emanuele Pozzi, Luca Cuffaro, Giulia Remoli
Università degli Studi di Milano-Bicocca, Milano, e Neurologia, IRCCS San Gerardo dei Tintori, Monza
Bibliografia
1. Word Health Organization. Optimizing Brain Health across the Life Course:; 2022. https://www.who.int/publications/i/item/9789240054561
2. Gustavsson A, Norton N, Fast T, et al. Global estimates on the number of persons across the Alzheimer’s disease continuum. Alzheimers Dement. 2023;19(2):658-670. doi:10.1002/alz.12694
3. Jessen F, Amariglio RE, Van Boxtel M, et al. A conceptual framework for research on subjective cognitive decline in preclinical Alzheimer’s disease. Alzheimer’s Dement. 2014;10(6):844-852. doi:10.1016/j.jalz.2014.01.001
4. Altomare D, Molinuevo JL, Ritchie C, et al. Brain Health Services: organization, structure, and challenges for implementation. A user manual for Brain Health Services—part 1 of 6. Alzheimer’s Res Ther. 2021;13(1):1-11. doi:10.1186/s13195-021-00827-2
5. Ranson JM, Rittman T, Hayat S, et al. Modifiable risk factors for dementia and dementia risk profiling. A user manual for Brain Health Services—part 2 of 6. Alzheimer’s Res Ther. 2021;13(1):1-12. doi:10.1186/s13195-021-00895-4
6. Visser LNC, Minguillon C, Sánchez-Benavides G, et al. Dementia risk communication. A user manual for Brain Health Services—part 3 of 6. Alzheimer’s Res Ther. 2021;13(1):1-12. doi:10.1186/s13195-021-00840-5
7. Solomon A, Stephen R, Altomare D, et al. Multidomain interventions: state-of-the-art and future directions for protocols to implement precision dementia risk reduction. A user manual for Brain Health Services—part 4 of 6. Alzheimer’s Res Ther. 2021;13(1):1-15. doi:10.1186/s13195-021-00875-8
8. Brioschi Guevara A, Bieler M, Altomare D, et al. Protocols for cognitive enhancement. A user manual for Brain Health Services—part 5 of 6. Alzheimer’s Res Ther. 2021;13(1):1-13. doi:10.1186/s13195-021-00844-1
9. Milne R, Altomare D, Ribaldi F, Molinuevo JL, Frisoni GB, Brayne C. Societal and equity challenges for Brain Health Services. A user manual for Brain Health Services—part 6 of 6. Alzheimer’s Res Ther. 2021;13(1):1-8. doi:10.1186/s13195-021-00885-6
10. Livingston G, Huntley J, Sommerlad A, et al. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet. 2020;396(10248):413-446. doi:10.1016/S0140-6736(20)30367-6
11. Frisoni GB, Molinuevo JL, Altomare D, et al. Precision prevention of Alzheimer’s and other dementias: Anticipating future needs in the control of risk factors and implementation of disease-modifying therapies. Alzheimer’s Dement. 2020;16(10):1457-1468. doi:10.1002/alz.12132
12. Andrieu S, Guyonnet S, Coley N, et al. Effect of long-term omega 3 polyunsaturated fatty acid supplementation with or without multidomain intervention on cognitive function in elderly adults with memory complaints (MAPT): a randomised, placebo-controlled trial. Lancet Neurol. 2017;16(5):377-389. doi:10.1016/S1474-4422(17)30040-6
13. van Charante EPM, Richard E, Eurelings LS, et al. Effectiveness of a 6-year multidomain vascular care intervention to prevent dementia (preDIVA): a cluster-randomised controlled trial. Lancet. 2016;388(10046):797-805. doi:10.1016/S0140-6736(16)30950-3
14. Ngandu T, Lehtisalo J, Solomon A, et al. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): A randomised controlled trial. Lancet. 2015;385(9984):2255-2263. doi:10.1016/S0140-6736(15)60461-5
15. Kivipelto M, Mangialasche F, Snyder HM, et al. World-Wide FINGERS Network: A global approach to risk reduction and prevention of dementia. Alzheimer’s Dement. 2020;16(7):1078-1094. doi:10.1002/alz.12123