Nel seguente articolo (parte 1 di 2) definiremo il concetto di Mild Cognitive Impairment (MCI) e proveremo a organizzarne un iniziale approccio diagnostico.
Secondo il DSM-V, i criteri diagnostici del MCI sono:
- Evidenza di un modesto deficit cognitivo in uno o più domini cognitivi (attenzione, funzioni esecutive, apprendimento e memoria, linguaggio, abilità percettivo-motorie, cognizione sociale) basata su:
– testimonianza del paziente, di un informatore attendibile o di un clinico; – riscontro di chiari deficit delle prestazioni cognitive in una valutazione neuropsicologica standardizzata; - Il deficit deve essere tale da NON interferire con l’autonomia e l’indipendenza funzionale del paziente
- Il deficit NON si manifesta esclusivamente nel contesto di delirium
- Il deficit NON è attribuibile ad altri disturbi mentali (es. disturbo depressivo maggiore o schizofrenia)
Ciò che contraddistingue il MCI dalla demenza è il mantenimento di un’autonomia da parte del paziente nello svolgere le attività di tutti i giorni. Il MCI può dunque essere considerato una fase intermedia nel continuum che va da una situazione di normalità cognitiva alla demenza.
La prevalenza dei pazienti con MCI aumenta con l’aumentare dell’età: nei paesi industrializzati si passa da una prevalenza di circa il 7% nella fascia d’età 60-64 a circa il 25% nella fascia 80-84.1
Riconoscere un’iniziale compromissione delle abilità cognitive è il primo passo nella gestione del MCI, a cui segue la ricerca di una o più cause determinanti il declino cognitivo.
Alla base del MCI vi potrebbero essere infatti cause reversibili, la cui identificazione e gestione potrebbero portare a una reversione, anche completa, del deficit cognitivo.
Tra di esse si annoverano:
- effetti collaterali di farmaci (in primis quei farmaci che svolgono azione ansiolitica, sedativa o antipsicotica) o interazioni di farmaci
- apnee notturne
- idrocefalo normoteso
- ematoma subdurale
- disordini endocrinologici
- carenze nutrizionali
A seconda delle coorti indagate, cause reversibili sono state identificate fino a quasi il 20% dei pazienti con MCI o demenza.2
Ciò tuttavia significa che, anche nello scenario più favorevole, in circa l’80% dei pazienti il deficit cognitivo è sotteso a cause irreversibili, soprattutto patologie neurodegenerative. L’irreversibilità del processo patologico dementigeno tuttavia non si traduce in una futilità del processo diagnostico.
Se la causa è irreversibile, definire una diagnosi di MCI – e della relativa causa – permette infatti di:
- aiutare paziente e familiari a dare una risposta al decadimento cognitivo
- discutere con paziente e caregiver della prognosi (l’MCI in senso lato ha un rischio di progressione a demenza fino a 3 volte superiore3 rispetto alla popolazione generale, rischio stratificabile grazie a specifici biomarker)
- sfruttare una fase di malattia caratterizzata da capacità di intendere per valutare con paziente e caregiver possibili scenari futuri (es. guida, porto d’armi, gestione delle finanze, amministratore di sostegno)
- proporre la partecipazione a progetti di ricerca e/o trial clinici
A tal fine, è dunque fondamentale procedere con l’inquadramento diagnostico per l’identificazione dell’esatta causa del decadimento cognitivo.
Se prendiamo in considerazione il consensus italiano per la diagnosi eziologica di MCI,3 possiamo vedere come la distinzione tra una causa reversibile di MCI e una causa irreversibile, nello specifico una causa neurodegenerativa, rappresenti il Tempo 0 dell’algoritmo diagnostico.
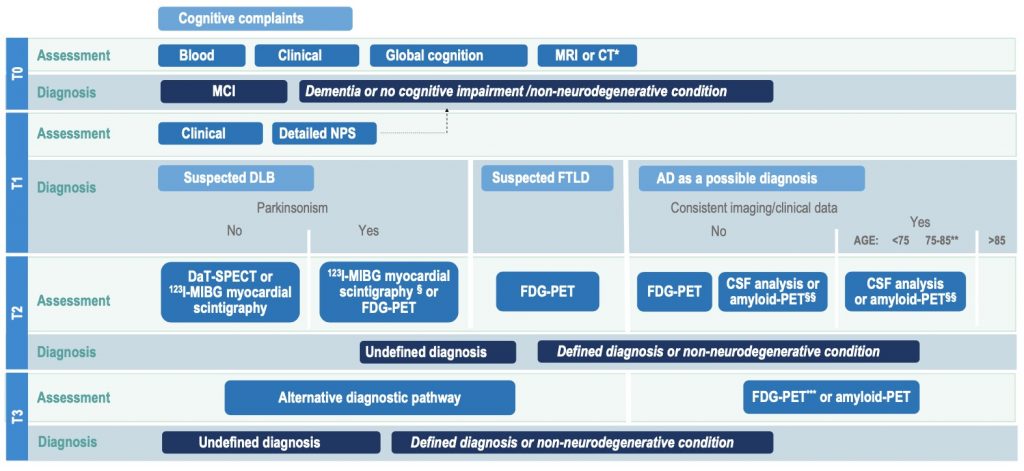
Al Tempo 0 dunque ritroveremo la prima visita del paziente, durante la quale procederemo innanzitutto a una dettagliata raccolta anamnestica. Nello specifico, partiremo dalla storia cognitiva del paziente esplorando i vari domini cognitivi e le varie manifestazioni cliniche ad essi associate (es. dimenticarsi la posizione di alcuni oggetti, perdersi in posti anche familiari, avere difficoltà a pianificare gli impegni, ad esprimersi o a trovare le parole, nel riconoscere volti noti o nel vestirsi). Già in questa fase potremo valutare l’impatto che il deficit cognitivo ha sulla vita di tutti i giorni, tramite l’applicazione di scale validate quali le ADL e le IADL.
Alla storia cognitiva aggiungeremo un’attenta ricerca di eventuali cambiamenti comportamentali, elemento potenzialmente dirimente nella definizione eziologica del deficit cognitivo. Chiederemo dunque attivamente circa una deflessione del tono dell’umore, una perdita di empatia, dei comportamenti inappropriati in pubblico, una disinibizione, un’iper-religiosità, dei comportamenti stereotipati o ritualistici, una perseverazione ed eccessiva rigidità mentale ma anche eventuali alterazioni dell’alimentazione (fissazioni, iperfagia e voracità). È infine utile indagare anche elementi suggestivi di un REM sleep behavior disorder, quali vocalizzazioni notturne o comportamenti motori complessi durante il sonno.
Di particolare aiuto su questo fronte è il racconto del caregiver, con cui, laddove presente, si dovrebbe parlare anche privatamente in modo da avere un confronto oggettivo del racconto anamnestico: il racconto del paziente con MCI potrebbe infatti essere non accurato anche a causa di un’iniziale anosognosia.
Concluderemo infine la raccolta anamnestica indagando:
- l’anamnesi fisiologica, con particolare attenzione a sviluppo psico-motorio, scolarità e attività lavorativa (e relativi rendimenti)
- l’anamnesi familiare, volta alla ricerca di altri membri della famiglia non solo con deficit di memoria o cognitivi in senso lato, ma anche con patologie psichiatriche, motorie od ossee. Nel caso volessimo ricostruire un albero genealogico, dovremmo prestare attenzione a riportare dettagliatamente l’età dei familiari al momento della visita, l’età di esordio di specifici sintomi o, nel caso, l’età del decesso (quest’ultima per escludere bias derivanti da un decesso precoce che non abbia permesso l’espressione fenotipica di una sottostante condizione genetica)
- l’anamnesi patologica remota e l’anamnesi farmacologica, con particolare attenzione a patologie pregresse e/o farmaci e/o interazioni farmacologiche che possano avere effetti sulle funzioni cognitive
Conclusa la raccolta anamnestica passeremo dunque all’obiettività neurologica. Il primo passo è innanzitutto la caratterizzazione oggettiva del deficit cognitivo: la valutazione cognitiva dovrebbe essere eseguita preferendo test con buona validità clinica, scelti in base alle caratteristiche del disturbo cognitivo e del paziente, nonché condotti attenendosi alle istruzioni di somministrazione.
Completeremo poi l’obiettività neurologica estendendola ai sistemi mancanti, con particolare attenzione alla valutazione della deambulazione e della motricità oculare estrinseca, nonché alla ricerca di segni di liberazione frontale (riflesso del muso, riflesso palmo-mentoniero e grasping), segni di parkinsonismo (ipertono plastico, bradicinesia, tremore a riposo, ipomimia) e fascicolazioni.
Concluderemo infine con un esame obiettivo generale comprensivo di una valutazione di pressione arteriosa (in clino- e ortostatismo), frequenza cardiaca e obiettività addominale.
Ritornando all’algoritmo diagnostico proposto dal consensus italiano, termineremo dunque la visita con la prescrizione di accertamenti diagnostici laboratoristici e di neuroimmagini.
Utili per escludere un contributo metabolico del disturbo cognitivo saranno esami del sangue estesi comprensivi di emocromo, coagulazione, funzionalità renale ed epatica, glicemia, emoglobina glicata, vit. B12 e folati, TSH reflex.
Elemento centrale per la successiva impostazione dell’iter diagnostico è infine la RM encefalo. Nel sospetto di patologie neurodegenerative dementigene è importante usare un protocollo minimo standard che includa immagini 3D T1-weighted per la valutazione dell’atrofia, 2D/3D T2-FLAIR per la valutazione di alterazioni della sostanza bianca e grigia, DWI per la valutazione della diffusività dell’acqua libera e T2*-weighted per la valutazione di microbleeds e siderosi superficiale. Se possible l’atrofia dovrebbe essere valutata tramite un’analisi quantitativa (es. Voxel-based morphometry), altrimenti applicando scale qualitative validate (es. Global Cortical Atrophy scale e Indice di Scheltens).
Terminato il Tempo 0 dovremmo dunque essere riusciti a escludere eventuali cause reversibili o non degenerative del deficit cognitivo. In tale scenario l’iter diagnostico procederà quindi verso la definizione della malattia neurodegenerativa sottesa all’MCI ramificandosi in tre percorsi a seconda del sospetto diagnostico: malattia di Alzheimer, demenza a corpi di Lewy o degenerazione lobare fronto-temporale.
Tratteremo tali percorsi nella seconda parte di questo articolo.
Simone Salemme
Interdepartmental Center of Neuroscience and Neurotechnologies (CfNN), University of Modena and Reggio Emilia, Modena.
simone.salemme93@gmail.com
Bibliografia |
- Petersen R.C. et al., Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology (2018)
- Muangpaisan W. et al., Prevalence of potentially reversible conditions in dementia and mild cognitive impairment in a geriatric clinic (2011)
- Petersen R.C. et al., Mild cognitive impairment: clinical characterization and outcome. Arch Neurol. (1999)
- Boccardi M. et al., Italian consensus for a biomarker-based aetiological diagnosis in mild cognitive impairment patients (2020)

