Il 21 marzo la BIOGEN ha annunciato l’interruzione di due trial farmacologici multicentrici gemelli EMERGE e ENGAGE per la dichiarata inefficacia di Aducanumab, finora oggetto di altri 4 trial farmacologici e protagonista di un altro studio che era in procinto di iniziare.
I due trial sperimentali in doppio cieco in fase III avevano come endpoint primario stabilire l’efficacia dell’aducanumab nel rallentare il deficit cognitivo e funzionale obiettivato dal punteggio CDR-SB nei pz affetti da AD lieve e AD prodromico.
Prerequisiti fondamentali per la partecipazione prevedevano un quadro compatibile per MCI correlato a AD o per AD lieve secondo i criteri National Istitute of Aging-Alzheimer Association con CDR- Global Score di 0.5, RBANS < 85 indicativo di deficit cognitivo oggettivo sulla base del dmi SCORE (delayed Memory index), MMSE score tra 24 e 30, la assenza alla RM encefalo di grave quadro di vasculopatia, la positività per la presenza di depositi amiloidei dimostrata con PET con tracciante specifico.
Lo studio constava di due fasi: una prima fase della durata di un anno e mezzo placebo controllata e una seconda fase di 2 anni in cui i pazienti sicuramente ricevevano il farmaco ma a due dosaggi differenti.
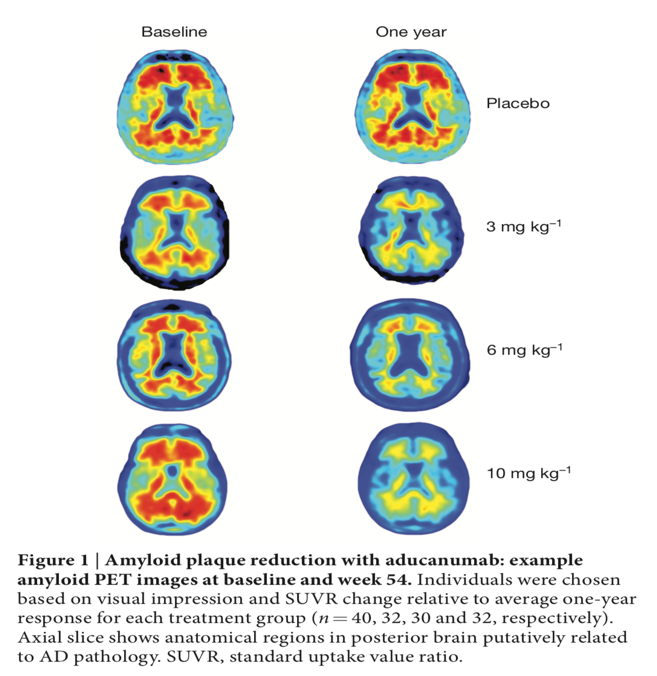
Grandi speranze erano state riposte sull’Aducanumab, soprattutto dopo la pubblicazione nel 2016 su Nature di un articolo di Sevigny et al. in cui veniva riportata l’evidenza (basata sui dati di PRIME,di fase 1b) dopo un anno di trattamento della riduzione dei depositi di placche amiloidee (rilevate con PET con tracciante specifico) nei pz che assumevano il farmaco secondo una entità direttamente proporzionale al dosaggio del farmaco stesso associato ad una stabilità o un minor declino delle performances ai test cognitivi CDR e MMSE nei pz nel braccio farmacologico.
Questo ha spinto ulteriormente la prosecuzione del trial che aveva come protagonista un farmaco con un profilo di sicurezza non del tutto trascurabile.
L’assunzione del farmaco infatti poteva causare ARIA con una percentuale fino a quasi il 50% nei pz che ricevevano il dosaggio maggiore del farmaco.
Per tale motivo erano previste da protocollo RM encefalo di controllo concentrate soprattutto, anche se non solo, nel periodo iniziale dello studio (periodo in cui tali eventi avversi sembravano essere più frequenti) che avevano come finalità quella di riscontrare la presenza subclinica di tali alterazioni.
Io sono una specializzanda al IV anno dell’ H San Gerardo di Monza, e sin dal primo anno mi sono occupata dello studio EMERGE. Definirei il trial più che impegnativo non solo per lo staff “investigatore” (comprendente anche neuropsicologi, neuroradiologi, medici nucleari) ma anche e soprattutto per pazienti e caregiver che mensilmente si presentavano presso il nostro centro per essere sottoposti in regime di day hospital a somministrazioni di flebo preparata dal personale infermieristico.
La flebo che poteva contenere al suo interno fisiologica 100 cc vs aducanumab diluito in fisiologica a tre differenti dosaggi (3 mg prokg, 6 mg prokg o 10 mg prokg) veniva somministrata in circa 1 h, seguiva poi l’infusione di liquido di lavaggio per cui per ad ogni seduta venivano dedicate circa 3 ore. Oltre agli appuntamenti mensili erano previste visite intermedie con esecuzione di Test Neuropsicologici e soprattutto più di sovente RM encefalo.
Tra gli esami preliminari nella fase di screening era prevista anche l’analisi genetica per l’apoE4. Sulla base della presenza o meno anche solo in eterozigosi dell’apoE4 i pazienti venivano suddivisi in apoE4+ e apoE4- che faceva sì che in pazienti venissero sottoposti nel I caso a flebo di placebo vs aducanumab a basse dosi (3 mg/kg) vs aducanumab ad alte dosi (6 mg/kg) mentre nel caso dei pz non portatori di apoE4 distinti in tre bracci in cui il dosaggio massimale del farmaco saliva fino a 10 mg/kg con i protocolli iniziali dello studio. Questa differenziazione si basava sul presupposto che gli ARIA si presentavano più spesso nei pazienti portatori dell’aplotipo E4.
Con le rivisitazioni successive dei protocolli invece veniva previsto che anche i pz con apoE4+ potessero ricevere farmaco al dosaggio massimale.
Nel nostro centro su 11 pazienti che hanno seguito attivamente la sperimentazione solo 2 hanno sviluppato ARIA, in entrambi i casi coinvolgente l’emisfero destro e asintomatiche.
Abbiamo interrotto il farmaco e assistito ad una autorisoluzione delle ARIA.
Non è stato pertanto necessaria la somministrazione di terapia antinfiammatorie come boli di Metilprednisolone che sono stati invece somministrati in altri centri in presenza di sintomatologia associata. Secondo alcuni l’ARIA si presenterebbe più frequentemente nei pazienti più “sensibili” all’azione dell’Aducanumab.
Purtroppo il farmaco non ha dato i risultati sperati per cui mi chiedo, dopo questa ennesima sconfitta sul fronte antiamiloide, quanto senso abbia continuare ad insistere su questa strategia terapeutica (è in fase di arruolamento lo studio ROCHE con un altro anticorpo monoclonale antiamiloide) o se sia meglio accontanarlo definitivamente per rivolgere lo sguardo agli anti tau o verso nuovi target terapeutici.
References: Sevigny J, Chiao P, Busierre T, et al. The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. Nature volume 537, pages 50–56
Giulia Nastasi
Milano Bicocca


