Il 29 giugno 2019 l’FDA ha ufficialmente annunciato l’approvazione di Eculizumab, un anticorpo monoclonale umanizzato diretto contro la componente C5 del complemento, nel trattamento della Neuromielite Ottica (NMOSD) positiva per anticorpi anti-AQP4.
Le NMOSD sono uno spettro di malattie infiammatore del sistema nervoso centrale ad eziopatogenesi immuno-mediata; l’andamento della malattia è remittente-recidivante con un accumulo progressivo di disabilità ad ogni ricorrenza e con alti tassi di mortalità, fattori che rendono fondamentale instaurare un trattamento immunosoppressivo a lungo termine per prevenire gli attacchi.
La patogenesi del danno astrocitario e neuronale delle NMOSD è tuttora oggetto di studi; esso è verosimilmente mediato dall’immunità umorale, ed è stato dimostrato il ruolo patogenetico diretto degli anticorpi anti-AQP4 nelle forme in cui essi sono presenti. Da studi su modelli pre-clinici sembra che il danno sia mediato dal sistema del complemento: in modelli animali l’iniezione intracerebrale di soli anticorpi anti-AQP4 non è sufficiente a scatenare la demielinizzazione, che invece avviene se insieme agli anticorpi viene iniettato un siero umano contenente i fattori del complemento. Nei topi, lesioni del sistema nervoso centrale simili a quelle delle NMOSD vengono riprodotte solo quando vengono iniettati anticorpi anti-AQP4 modificati in maniera tale da potenziare l’attivazione del complemento (CDC) e la citotossicità anticorpo-mediata (ADCC), ma non se manca uno di questi due elementi. Nei ratti in cui è stato somministrato l’anticorpo anti-AQP4 per via periferica, infine, il danno centrale viene prevenuto dalla deplezione del complemento.
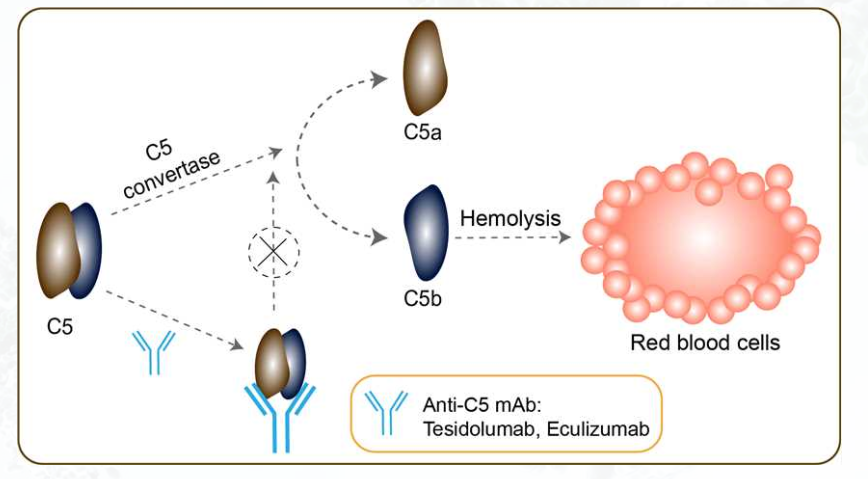
Non vi sono linee guida ben definite nel trattamento delle NMOSD, né trattamenti approvati specificatamente per la malattia; le terapie a cui i pazienti sono sottoposti (corticosteroidi, immunosoppressori, anticorpi monoclonali come il Rituximab) sono quindi off-label. Giunge come un buon auspicio l’approvazione di Eculizumab nel trattamento delle NMOSD anti-AQP4 positive, approvazione redatta in seguito ai risultati positivi dello studio PREVENT.
PREVENT è un trial clinico time-to-event, randomizzato in doppio cieco, che ha reclutato 143 pazienti, randomizzati con rapporto 2:1 ad Eculizumab ev (una dose da 900 mg alla settimana per le prime 4 dosi, e successivamente una dose di mantenimento da 1200 mg ogni due settimane) versus placebo. Sono stati esclusi pazienti che avevano effettuato terapia con Mitoxantrone o Rituximab nei 3 mesi precedenti, IVIg nelle 3 settimane precedenti, o che assumevano più di 20 mg/die di prednisone o dose equivalente, mentre altre terapie immunosoppressive che i pazienti assumevano sono state proseguite durante il trial. L’endpoint primario la prima ricaduta accertata; lo studio è stato concluso dopo 23 ricadute delle 24 inizialmente previste. 3 pazienti, dei 96 trattati con Eculizumab, ha avuto una ricaduta (3%), contro i 20 su 47 del gruppo placebo (43%) (p<0,001). Il tasso di ricaduta per anno era 0,02 nel gruppo Eculizumab e 0,35 nel gruppo placebo, quindi con una riduzione significativa del numero di ricadute per anno ed una riduzione del rischio di attacchi del 94%. Non è stata rilevata una differenza significativa nelle scale di progressione di disabilità applicate (EDSS, mRS, Hauser Ambulation Index, EQ-5D-3L) fra i due gruppi, ma tale risultato può essere addotto alla breve durata dello studio ed al fatto che il follow-up dopo la ricaduta durava al massimo 6 settimane. Gli eventi avversi più frequentemente associati con il trattamento con Eculizumab sono stati infezioni delle alte vie respiratorie e cefalea; da notare comunque che il numero di eventi avversi è risultato maggiore per i pazienti che hanno assunto con placebo, e che prima del trial tutti i pazienti sono stati sottoposti a vaccinazione per meningococco.
L’efficacia di Eculizumab è un risultato incoraggiante; chissà che nel futuro, approfondendo maggiormente la patogenesi delle NMOSD, non si possano scoprire potenziali nuovi potenziali target farmacologici che possano dare speranza a migliaia di pazienti affetti da questa devastante malattia.
A questo proposito, fra i nuovi agenti che potrebbero essere approvati nel breve termine nel trattamento delle NMOSD, da tenere d’occhio:
- Inebilizumab, che lega ad alta affinità il CD19 causando così una significativa deplezione dei linfociti B, nello studio N-Momentum è stato utilizzato come monoterapia nei pazienti affetti da NMOSD sia anticorpi anti-AQP4 positivi che negativi, e ha dimostrato una riduzione del rischio di attacchi del 77%. Ha ricevuto nel marzo 2019 il Breakthrough Therapy Designation dall’FDA
- Satralizumab, anticorpo umanizzato diretto contro il recettore dell’IL-6, è in studio nel trial SAkuraSky come terapia aggiuntiva nelle NMOAS anti-AQP4 positive o negative, e nel trial SAkuraStar come monoterapia nelle NMOSD anti-AQP4 positive. Il farmaco nel dicembre 2018 ha ricevuto il Breakthrough Therapy Designation dall’FDA per i risultati positivi ottenuti in particolare nel SAkuraStar
Lucia Campetella, Università Cattolica, Roma
References:
Pittock, S. J., Berthele, A., Fujihara, K., Kim, H. J., Levy, M., Palace, J., … Wingerchuk, D. M. (2019). Eculizumab in Aquaporin-4–Positive Neuromyelitis Optica Spectrum Disorder. New England Journal of Medicine, NEJMoa1900866. https://doi.org/10.1056/NEJMoa1900866
Thurman, J. M., & Yapa, R. (2019). Complement therapeutics in autoimmune disease. Frontiers in Immunology, 10(APR). https://doi.org/10.3389/fimmu.2019.00672