La proteina TDP-43, trascritto del gene TARDBP, è una proteina DNA/RNA-legante, implicata nel metabolismo dell’RNA, in particolare mediandone il trasporto tra nucleo e citoplasma, espressa principalmente nel SNC e negli elementi mononucleati del sangue (PBMC).
Nello spettro SLA-FTD (97% dei casi di SLA, 50% dei casi di FTD) si riscontrano di frequente depositi citoplasmatici di TDP-43 iperfosforilata o ubiquitinata.
Mutazioni del gene TARDBP (circa il 4% dei casi di SLA familiare) dimostrano un collegamento diretto tra la proteinopatia e la neurodegenerazione, ma il meccanismo esatto rimane poco chiaro.
La ciclofilina A/PPIA (Peptidyl-prolyl cis-trans isomerase A) è un enzima altamente espresso nel SNC, prevalentemente nei neuroni, e sembra possedere funzioni distinte a seconda della localizzazione:
1. iPPIA (intracellulare): promuove il folding proteico, agisce da chaperone molecolare e protegge da ROS e misfolding proteico; regola, inoltre, l’interazione di TDP-43 con gli RNA target, modulando l’espressione di geni quali VCP, FUS e GRN, implicati anch’essi nella patogenesi di SLA e FTD.
2. ePPIA (extracellulare): citochina proinfiammatoria, secreta in risposta a stress; attiva il pathway pro-apoptotico mediato da CD147, NF-kB e MMP-9
Lo studio di Pasetto et al. esplora il ruolo patogenetico della ciclofilina A e delle sue anomalie da due punti di vista, su ratti PPIA-knockout e su PBMC estratte da pazienti affetti da SLA e da controlli sani.
Gli studi sul ratto hanno dimostrato una netta riduzione di volume corticale e ippocampale nei ratti PPIA -/- rispetto ai controlli a 6 e 12 mesi, corrispondente a una perdita neuronale nelle indagini neuroistologiche. Inoltre, nei neuroni dei topi PPIA -/- si è riscontrato un aumento significativo e progressivo con l’età di TDP-43 citoplasmatica e una riduzione di TDP-43 nucleare.
Rispetto all’interazione con TDP-43, è stata dimostrata una downregolazione sia dei trascritti TDP-43-dipendenti, sia del mRNA TARDBP, quindi gli autori suggeriscono che la carenza di PPIA possa allo stesso tempo inibire l’autoregolazione di TDP-43 e di conseguenza rallentarne la produzione.
Inoltre, nei modelli animali PPIA-mutati, non essendo espressa la forma extracellulare ePPIA, si è osservata una riduzione dell’attività neuroinfiammatoria, a significare cheil rapporto iPPIA/ePPIA contribuisce al ruolo patogenetico della ciclofilina A.
Collateralmente è stata condotta un’analisi in vivo sui ratti PPIA knockout, che ha evidenziato l’incremento di disfunzione ippocampale, determinante disturbi socio-comportamentali e mnesici, e la riduzione del volume muscolare, associata a minore sopravvivenza generale.
Le analisi su PBMC umane, invece, hanno evidenziato bassi livelli di PPIA acetilata associato a una significativa downregolazione del gene responsabile a livello di mRNA nel campione affetto rispetto ai soggetti sani (non sono state rilevate invece differenze nei livelli di TDP-43).
Nella coorte di pazienti studiata è stato inoltre descritto un soggetto con mutazione diretta del gene codificante PPIA, affetto da SLA a lenta progressione senza interessamento cognitivo precoce.
Da questo studio emerge quindi un ruolo fondamentale di PPIA nel regolare sia la funzione di TDP-43 sia l’attività neuroinfiammatoria, presente nello spettro SLA-FTD.
È stato perciò costruito un modello di funzionamento, fisiologico e patologico, di PPIA:
1. Soggetto sano: iPPIA agisce da foldasi e protegge i motoneuroni dagli effetti del misfolding proteico; ePPIA viene secreta in risposta a stress cellulare e infiammazione, attivando pathway pro-apoptotici
2. Soggetti affetti da SLA/FTD: viene meno la funzione di iPPIA, determinando una proteinopatia da TDP-43 e di conseguenza attivando fenomeni neurodegenerativi; ePPIA viene secreta erroneamente e contribuisce ai fenomeni neuroinfiammatori 3. Topi PPIA -/-, soggetti PPIA-mutati: l’assenza completa di PPIA induce la proteinopatia TDP-43, ma non attiva pathway infiammatori, determinando un esordio tardivo e una più lenta progressione
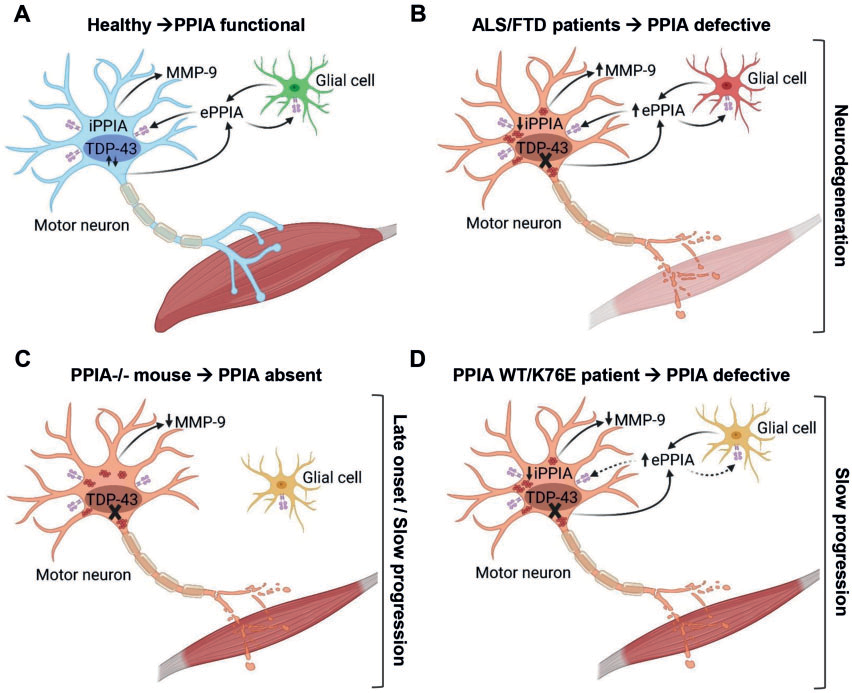
In conclusione, questo studio, tramite un ottimo disegno sperimentale, getta luce su un pathway fisiopatologico poco studiato e delinea un ruolo fondamentale di PPIA nella patogenesi dello spettro SLA-FTD, ipotizzando inoltre un possibile futuro ruolo come target di terapie specifiche.
Matteo Farè
Università degli Studi Milano-Bicocca
m.fare3@campus.unimib.it


