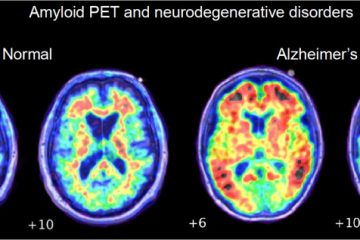
La malattia di Alzheimer è tradizionalmente definita come un’entità clinico-patologica. Tuttavia negli ultimi anni sono stati individuati marcatori biologici sia a livello liquorale (Aβ-42, Tau, Fosfo-Tau) sia a livello di PET (PET amiloide, PET tau) che hanno permesso di individuare le alterazioni neuropatologiche patognomoniche prima del riscontro autoptico. A questi avanzamenti diagnostici si aggiunge la sempre maggiore consapevolezza che i test neuropsicologici formali non riescono a fornire una sufficiente sensibilità e specificità per la neuropatologia alzheimeriana a causa di numerosi mimics. D’altronde questo riscontro è comprensibile in quanto non è possibile individuare una correlazione univoca tra lesione biologica elementare ed alterazione delle prove neuropsicologiche. Questo tuttavia non esclude la possibilità di individuare network funzionali che vengono alterati in maniera specifica in una data patologia degenerativa.
Quindi nei recenti (2014) criteri IWG-2, per porre diagnosi di malattia di Alzheimer, insieme al classico fenotipo clinico (che rimane comunque necessario), viene ad aggiungersi la dimostrazione in vivo della patologia alzheimeriana (diminuizione di Aβ-42 con aumento di Tau e Fosfo-Tau nel liquor, positività della PET amiloide o la presenza delle mutazioni causali di malattia – APP, PS1, PS2). Questa revisione si va ad innestare nei cambiamento di paradigma iniziato con i criteri IWG del 2007 che ha portato la malattia di Alzheimer ad essere considerata un’entità clinico-biologica da una clinico-patologica.
Su questa scia si viene ad inserire il recentissimo articolo (Aprile 2018) prodotto dalla NIA-AA che riguarda l’aggiornamento delle linee guida per la diagnosi di malattia di Alzheimer in ambito di ricerca. Il punto focale di questo lavoro è la definizione della patologia stessa; quest’ultima è definita come l’insieme dei cambiamenti neuropatologici caratteristici definiti in vivo dai biomarcatori e dallo studio post-mortem e NON dai sintomi clinici.
I due biomarcatori presi in considerazioni sono l’amiloide (Aβ-42 e rapporto Aβ-42/Aβ-40 nel liquor e la PET amiloide) e la proteina tau (Fosfo-Tau nel liquor e Tau-Pet). A questi si aggiungono i segni di neurodegenerazione individuati tramite RM, FDG-PET e Tau nel liquor. La differenza tra Tau e fosfo-Tau è dovuta alla non specificità della prima che può elevarsi anche in altre condizioni, come nel trauma cranico, ictus e malattia di Creutzfeldt-Jakob. Dall’insieme della positività o negatività di questi marcatori si definiscono varie categorie, in particolare tutte le condizioni caratterizzate dalla presenza di amiloide rientrano nel continuum dell’Alzheimer mentre l’assenza di quest’ultima individua un quadro patologico non alzheimeriano. Nel continuum dell’Alzheimer la presenza di biomarker tau determina la presenza di malattia di Alzheimer propriamente detta.
SCHEMA
- Amiloide NEG Tau NEG Neurodeg NEG ————– Marcatori negativi
- Amiloide POS Tau NEG Neurodeg NEG ————–Alterazioni dovute a AD
- Amiloide POS, Tau POS, neurodegenerazione NEG oppure Amiloide POS, Tau POS, neurodegenerazione POS ———- Malattia di Alzheimer
- Amiloide POS, tau NEG, neurodegenerazione POS ———- Alterazioni dovute a patologia alzheimeriana concomitante ad altra patologia
- Amiloide NEG, tau POS, neurodegenerazione NEG oppure Amiloide negativa, tau negativa, neurodegenerazione presente oppure Amiloide negativa, tau positiva, neurodegenerazione presente ———— Alterazioni non dovuti a patologia alzheimeriana
Modificato da NIA-AA Research Framework: Toward a biological definitionof Alzheimer’s disease (Alzheimer’s & Dementia – 2018)

In quest’ottica si colloca anche il progetto INTERCEPTOR. Questo studio multicentrico italiano ha lo scopo di individuare uno o più biomarcatori ideali (cioè dotati di alta accuratezza, non invasività, disponibili sul territorio e con un costo sostenibile) tra una serie di potenziali scelte che indentifichi la malattia di Alzheimer prodromica.
In conclusione, la prevalenza in aumento della malattia e la mancanza di una terapia efficace rappresenteranno una sfida enorme nei prossimi anni; pertanto appare chiaro come una diagnosi precoce risulterà sempre più importante anche al fine di ricercare un farmaco in grado di modificare in maniera significativa la storia di malattia.
Tuttavia è doveroso porre la domanda della sostenibilità dei costi: è veramente pensabili sottoporre tutti i sospetti malati di Alzheimer all’esame del liquor o alla PET amiloide?
Infine rimangono aperte numerose questioni riguardanti la valutazione neuropsicologica: risulta chiaro la necessità di modificare la tendenza ad affidarsi esclusivamente al punteggio grezzo della prova ma di puntare ad un’analisi qualitativa strutturata che permetta di analizzare delle caratteristiche importanti per la diagnosi differenziale che andrebbero altrimenti perse. Inoltre risulta necessario individuare marker neuropsicologici che si alterino precocemente nella storia di malattia, prima del disturbo di memoria episodica, come il comportamento attenzionale (conjunction search) della working memory (memory binding) ed il deficit di memoria semantica (dissociazioni categoriali, perdita del magazzino semantico, imporverimento della componente della conoscenza).
Andrea Plutino, Ancona
Bibliografia:
https://www.ncbi.nlm.nih.gov/pubmed/29653606
http://www.aifa.gov.it/sites/default/files/Allegato-1_Study-Protocol_INTERCEPTOR.pdf