Introduzione
I trattamenti immunomodulatori e immunosoppressori per la sclerosi multipla (SM) sono associati ad un aumentato rischio di infezione, il che rende difficile il trattamento di questa condizione nella pratica clinica quotidiana. L’uso di una gamma crescente di farmaci disponibili per il trattamento della SM richiede una conoscenza approfondita delle infezioni associate al trattamento, strategie di riduzione del rischio e approcci al monitoraggio e al trattamento di tali eventi avversi. La spiegazione precisa dei rischi infettivi associati alle terapie immunosoppressive per la SM è talvolta complicata da fattori come bassa frequenza e presentazioni ritardate oltre che dalle conoscenze solo parziali delle interazioni tra il sistema immunitario e i farmaci. I dati degli studi clinici sulla SM possono essere fuorvianti a causa di screening e approcci diagnostici variabili, mentre l’estrapolazione da studi sui farmaci per il trattamento di malattie non neurologiche può essere fuorviante a causa della presenza di ulteriori fattori di rischio in questi altri pazienti.
Vi presenterò i dati derivanti dai più importanti studi clinici dei famaci più utilizzati per il trattamento della SM, orali e infusivi, come riportati da David J. Epstein, Jeffrey Dunn, and Stan Deresinski. Infectious Complications of Multiple Sclerosis Therapies: Implications for Screening, Prophylaxis, and Management. Open Forum Infectious Disease 2018.
Tubercolosi
I farmaci più probabilmente, o meglio, plausibilmente associati ad aumentato rischio di attivazione o progressione della TBC sono quelle interferenti con l’immunità cellulo-mediata, al contrario i farmaci depletivi delle cellule CD20 non dovrebbero influenzare questo rischio.
L’Alemtuzumab, in quanto anti-CD52, ha un’azione immunodepletiva sia sulle cellule dell’immunità umorale che su quelle dell’immunità cellulo-mediata. In 2 trial (CARE-MS1 e CARE-MS2) coinvolgenti più di 900 pazienti e 400 controlli si sono rilevati 2 casi di riattivazione nei pazienti e nessuno nei controlli (nonostante lo screening pre-trattamento esteso a tutti i soggetti partecipanti). La Teriflunomide, inibitore della diidrorotato deidrogenasi, interferendo nella sintesi delle purine influenza negativamente la proliferazione dei linfociti. In linea con il suo meccanismo, 3 casi di riattivazione sono stati riportati in circa 2000 pazienti trattati, comunque in molti di questi studi lo screening pre-terapeutico non era mandatorio.Quindi, lo screening per TBC prima di iniziare la terapia con Alemtuzumab o Teriflunomide è fortemente raccomandato.
L’Ocrelizumab (come il Rituximab) non interferisce con l’immunità cellulo-mediata, o comunque lo fa indirettamente e parzialmente, e per questo non ci si aspetta un aumentato rischio di TBC. In 3 grandi trial clinici nessun caso è stato rilevato nonostante lo screening non fosse previsto.Quindi, lo screening per TBC prima di iniziare la terapia con Ocrelizumab o Rituximab non è raccomandato di routine.
Natalizumab, Fingolimod e Dimetil-fumarato hanno meccanismi d’azione completamente diversi, tutti interferiscono però con l’immunità cellulo-mediata. Nonostante ciò, i dati derivanti dai trial e dall’osservazione post-marketing non mostrano un aumentato rischio di TBC per questi farmaci.Quindi, lo screening per TBC prima di iniziare la terapia con Natalizumab, Fingolimod o Dimetil-fumarato è da prendere in considerazione nei soggetti ad alto rischio epidemiologico o con altri fattori favorenti la riattivazione.
Indipendentemente dal trattamento, lo screening per TBC latente è raccomandato per tutti quei pazienti candidati alla terapia e ad alto rischio, cioè affetti da diabete mellito, insufficienza renale cronica o immigrati da paesi ad alta incidenza.
Epatite B
È noto che i farmaci depletivi delle cellule B aumentano in maniera sensibile il rischio di riattivazione dell’infezione da HBV nonché il rischio che le manifestazioni della riattivazione siano gravi. Nonostante ciò, la patofisiologia delle infezioni virali indotte da farmaci anti-CD20 (rituximab, ocrelizumab) non è chiara. Il meccanismo alla base della riattivazione dell’HBV a seguito del trattamento con Rituximab è probabilmente più complesso della semplice deplezione delle cellule B. I linfociti B possono stimolare le risposte immunitarie cellulari, sia agli autoantigeni che agli antigeni estranei. Inoltre, Stasi e colleghi hanno dimostrato che a seguito del trattamento con Rituximab si verificano cambiamenti significativi nell’attività dei linfociti T, inclusi un aumento dei rapporti Th1/Th2 e Tc1/Tc2, una maggiore espressione del ligando di Fas sulle cellule Th1 e Th2 e l’espansione delle cellule T oligoclonali. Un ruolo per l’importanza dei linfociti B nella riattivazione dell’HBV può anche essere in parte correlato alla riduzione degli anticorpi anti-HBV (cioè HBsAb +) causati dal Rituximab e dal relativo bilancio dell’immunità dell’ospite. Tsutsumi e colleghi hanno dimostrato che nonostante i livelli sierici di immunoglobuline siano rimasti costanti durante il trattamento, i titoli anticorpali di superficie anti-HBV sono significativamente diminuiti con la terapia con Rituximab.
Ciononostante, l’analisi rischio beneficio non valuta solo il rischio di infezione legato alla terapia ma anche l’efficacia dei test di screening disponibili e l’efficacia, nonché la tossicità, dei farmaci per combattere l’infezione. Nel caso dell’epatite B, e a differenza della tubercolosi i test diagnostici hanno sensibilità e specificità molto maggiore e la terapia, oltre che molto efficace, ha minori effetti collaterali. Per questo motivo in tutti i pazienti candidati a terapia immunosoppressiva o immunomodulatoria, indistintamente dalla terapia che si è decisi di intraprendere, lo screening pretrattamento per l’epatite B (almeno HBsAg e anti-HBc) è raccomandato.
Nello specifico, il rischio di infezione grave è altissimo per i pazienti in terapia con anti-CD20 (Ocrelizumab e Rituxiamb). Segue l’Alemtuzumab che comporta una profonda depressione anche dell’immunità umorale. Per i restanti farmaci i dati derivanti dai trial principali non delineano il rischio con chiarezza. Plausibilmente, il rischio di riattivazione e di infezione grave è basso per Fingolimod, Dimetil Fumarato e Teriflunomide e si pone in una posizione intermedia per Natalizumab. Il Natalizumab è un anticorpo monoclonale anti-VLA4 (VLA4 è un’ integrina) che agisce impedendo l’adesione e la migrazione linfocitaria dal letto vascolare alla sede di infiammazione. Nonostante le integrine sembrerebbero avere un ruolo determinante nel trafficking linfocitario a livello epatico, l’implicazione nel controllo dell’infezione da HBV non è chiaro, e nessun caso di infezione è stato riportato nei principali trial clinici.
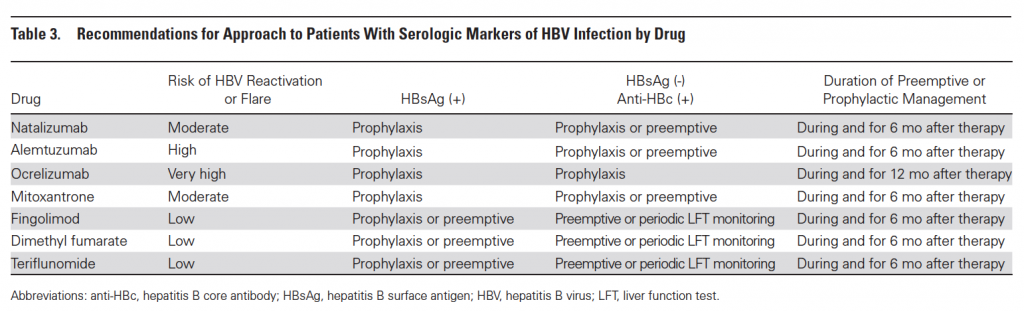
Pazienti ad alto rischio di riattivazione. Come comportarsi? Per l’Ocrelizumab, nel caso di pazienti con positività a qualsiasi marker di infezione, passato o presente, si dovrebbe eseguire profilassi farmacologica per tutta la durata della terapia e fino a 12 mesi dopo. Per tutti gli altri farmaci non esistono dati a sufficienza per poter delineare una guida al management del paziente con una positività ai marker che, quindi, dovrà basarsi sul rischio specifico del farmaco, sul rischio del paziente (in funzione della positività ad HBsAg o ad anti-HBc) e sulle preferenze del paziente. Si possono scegliere 3 diversi atteggiamenti:
- Solo monitoraggio con dosaggio periodico dei marker di funzionalità epatica (in Tabella 1 “periodic LFT monitoring”);
- Monitoraggio dell’HBV DNA ogni 3 mesi e iniziare terapia farmacologica solo in caso di rialzo di quest’ultimo (in Tabella 1 “preemptive”);
- Terapia farmacologica di profilassi (in Tabella 1 “prophylaxis”).
Qualunque sia il tipo di strategia di gestione del rischio infettivo che si sceglie, questa dovrà protrarsi fino ad almeno 6 mesi dopo l’ultima dose di farmaco eccetto che per l’Ocrelizumab che, per l’alto rischio di riattivazione anche tardiva, richiede che la terapia di profilassi per l’epatite B (scelta obbligata nel caso dell’anti-CD20 in paziente ad alto rischio di riattivazione) si protragga fino, ad almeno, 12 mesi. In Tabella 1 troverete una riassuntiva guida sul comportamento da seguire per singolo farmaco e in funzione del rischio del paziente.
Herpes Virus (HSV1, HSV1, VZV, CMV)
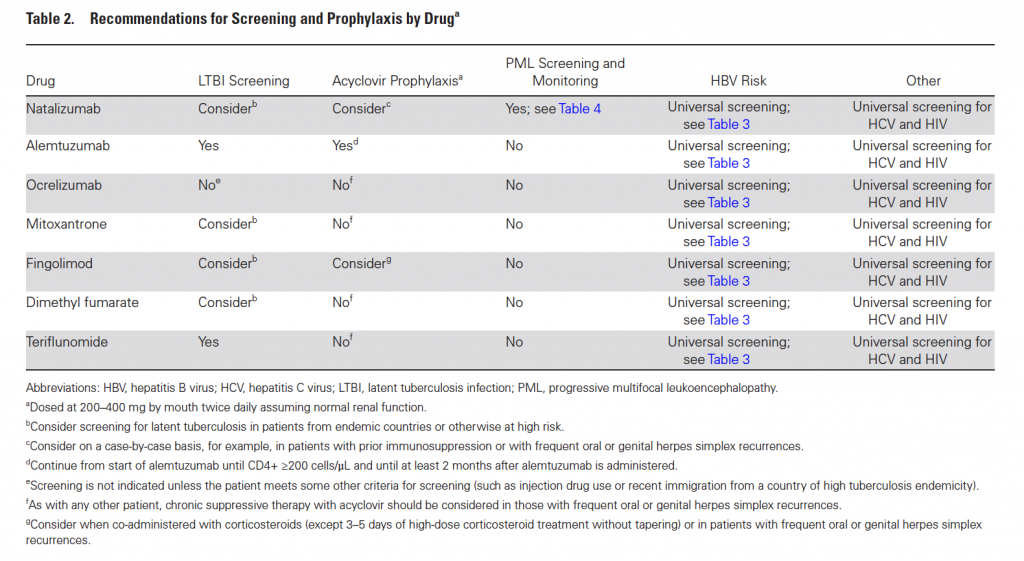
L’Alemtuzumab comporta un aumentato rischio di infezioni gravi o molto gravi da HSV e VZV. Per questo prima di iniziare la terapia è necessaria la vaccinazione se non presenti le IgG anti-VZV così come è necessaria in tutti i pazienti la terapia profilattica con Aciclovir al dosaggio di 400 mg/die per tutta la durata del ciclo di trattamento e fino a che i linfociti non siano risaliti almeno a 200 e comunque almeno per 2 mesi dalla fine del ciclo (anche se i linfociti dovessero risalire in meno tempo). In considerazione del basso rischio di malattia da CMV in questi pazienti, il monitoraggio preventivo con PCR non è raccomandato.
Per il suo meccanismo d’azione il Fingolimod dovrebbe aumentare il rischio di infezione da HSV e VZV grave e diversi casi di infezione, anche fatale, sono stati riportati. Nonostante ciò successive analisi, su popolazioni più ampie, hanno documentato come l’incremento del rischio di infezioni, soprattutto gravi da HSV e VZV non è alto. Quindi, se come per l’Alemtuzumab, tutti i pazienti non immunizzati dovrebbero fare il vaccino per la Varicella non è invece raccomandata la profilassi con Aciclovir. Questa potrebbe essere presa in considerazione nei periodi di concomitante terapia corticosteroidea (questa, infatti, in associazione al Fingolimod incrementa sensibilmente il rischio di infezione da HSV) o in pazienti con frequenti recidive erpetiche orali o genitali.
Il Natalizumab si può raramente complicare con gravi infezioni del SNC da parte di HSV e VZV come si è evidenziato dai diversi casi rilevati post-marketing. Nonostante in alcuni pazienti l’esito è stato infausto o gravemente disabilitante, la maggior parte ha recuperato. Necessaria la vaccinazione per la Varicella prima di iniziare ma non è prevista profilassi con Aciclovir che eventualmente sarebbe da prendere in considerazione nei pazienti con precedente immunosoppressione e con frequenti recidive erpetiche orali o genitali. L’Ocrelizumab non aumenta il rischio di infezione da Herpes Virus così come non vi è evidenza che lo aumentino la terapia con Teriflunomide e con Dimetil Fumarato.
Epatite C e HIV
In considerazione della prevalenza e delle implicazioni cliniche di queste infezioni, in ogni caso è suggerito lo screening per queste due malattie virali.
In Tabella 2 sono presentate tutte le raccomandazioni discusse fino ad ora.
Infezioni opportunistiche e altre infezioni
Le infezioni opportunistiche tipicamente associate a infezione da HIV diverse da quelle già discusse sono state riportate raramente in associazione con terapie per la Sclerosi Multipla, e principalmente con farmaci che influenzano il traffico di linfociti, come Natalizumab e Fingolimod, o quelli che provocano l’esaurimento dei linfociti T, come l’Alemtuzumab. Meningite criptococcica, criptococcosi cutanea e disseminata sono state raramente riportate con l’uso di Fingolimod e, in misura minore, con Natalizumab. Casi individuali di sarcoma di Kaposi, istoplasmosi cutanea e toxoplasmosi del sistema nervoso centrale sono stati riportati anche in pazienti non infetti da HIV con SM che ricevevano Fingolimod. Allo stesso modo, rari casi di polmonite da Pneumocystis, nocardiosi e listeriosi sono stati riportati con Alemtuzumab in pazienti con SM. Lo screening o la profilassi di routine non sono indicati in questa popolazione, anche se i medici dovrebbero essere attenti alla possibilità di queste infezioni opportunistiche insolite.
Diverse terapie anti-MS, tra cui Alemtuzumab e Ocrelizumab, sono associate ad un aumento complessivo statisticamente significativo del rischio di infezione, principalmente nasofaringite lieve/moderata, infezioni del tratto respiratorio superiore e infezioni del tratto urinario, sebbene non sia indicato un approccio preventivo specifico. Nonostante le infezioni opportunistiche associate a Fingolimod e Natalizumab, negli studi clinici non è stato osservato un aumento del rischio di infezioni complessive. La Teriflunomide non è stata associata ad un aumentato rischio di infezioni complessive e studi clinici sul Dimetilfumarato hanno riscontrato risultati contrastanti sul rischio di infezione.
Leucoencefalopatia Multifocale Progressiva
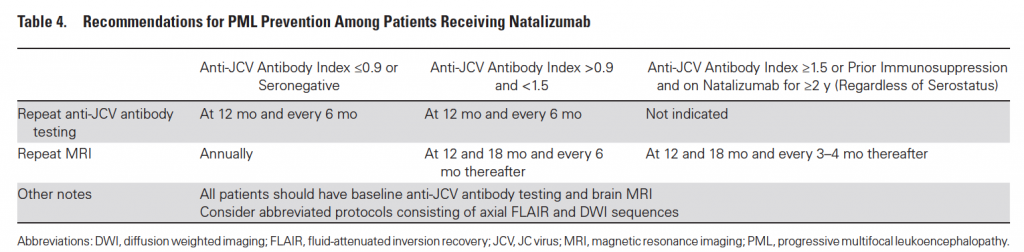
La Leucoencefalopatia Multifocale Progressiva è una grave infezione opportunistica di pertinenza quasi esclusiva del Natalizumab. Pochi casi sono stati descritti in letteratura in pazienti in terapia con Fingolimod e Dimetil-Fumarato. Oltretutto, lo screening per il JC virus, e quindi la gestione del rischio per PML, sono previsti solo per il Natalizumab e si fondano su un algoritmo ben più strutturato di qualsiasi altro visto fin ora (riassunti in Tabella 3 e in Tabella 4).

- David J. Epstein, Jeffrey Dunn, and Stan Deresinski. Infectious Complications of Multiple Sclerosis Therapies: Implications for Screening, Prophylaxis, and Management. Open Forum Infectious Disease 2018.
Gianmarco Abbadessa – Università della Campania “Luigi Vanvitelli” – gianmarcoabbadessa@gmail.com