Una sintesi della review di Giovannoni et al. Is Multiple Sclerosis a length-dependent central axonopathy? The case for therapeutic lag and the asynchronous progressive MS hypotheses – MSARD 2017
https://www.msard-journal.com/article/S2211-0348(17)30008-1/fulltext
di Gianmarco Abbadessa (Napoli Vanvitelli)
Background
Nonostante la Sclerosi Multipla sia solita esordire con andamento recidivante-remittente, nel corso della vita del paziente il quadro clinico è dominato da quella che viene definita “fase progressiva” di malattia, caratterizzata dall’accumulo ingravescente di disabilità. Quando questa fase inizi è materia di dibattito: di fatto si tratta di una definizione clinica, affidata quindi alla sensibilità del neurologo, e spesso posta in maniera retrospettiva. Il substrato neuropatologico sottostante la progressione è rappresentato dall’infiammazione cronica e diffusa, dall’attivazione microgliale, dalla demielinizzazione, dalla gliosi e in particolare dal danno assonale. Oggi sappiamo che tutti questi processi sono rilevabili sin dalle prime fasi della malattia, ben prima che la progressione sia clinicamente evidente. Ad esempio studi di RM evidenziano come un’accelerazione del processo di atrofia cerebrale sia osservabile anche per i pazienti con sindrome radiologicamente isolata o SM subclinica (http://neuromag.it/sindrome-radiologicamente-isolata-o-sclerosi-multipla-subclinica/). Queste osservazioni suggeriscono come non esista una reale ed evidente transizione dalla fase recidivante-remittente a quella progressiva, ma piuttosto un continuum di malattia sotteso da meccanismi fisiopatologici strettamente relazionati tra loro: 1) infiammazione (acuta-focale e cronica-diffusa); 2) danno assonale acuto; 3) degenerazione ritardata di tratti neuroassonali demielinizzati e/o vulnerabili.
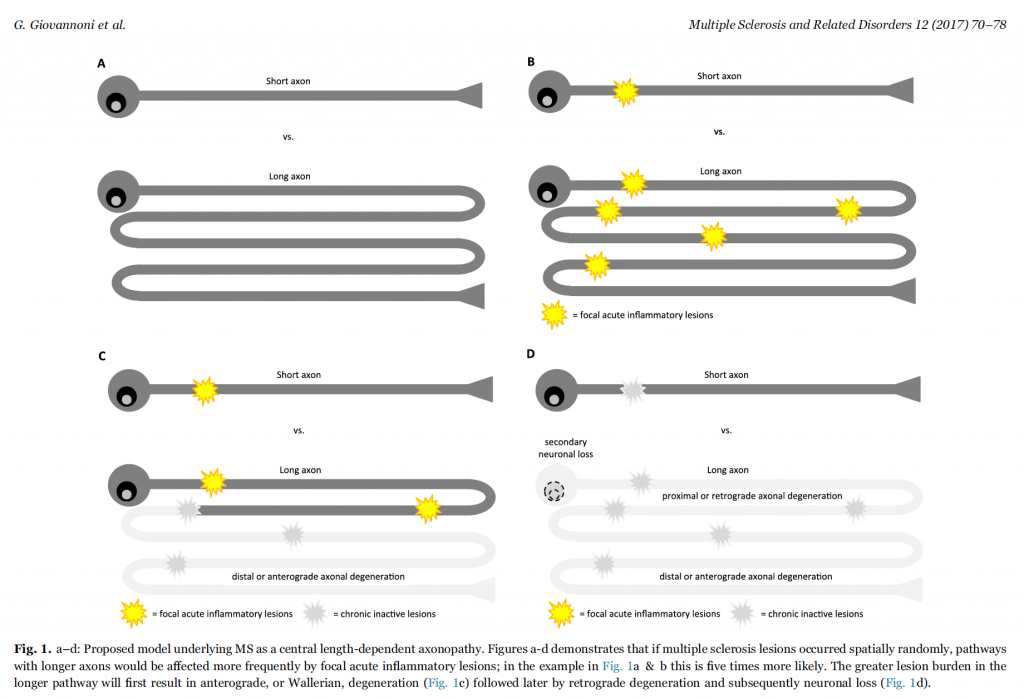
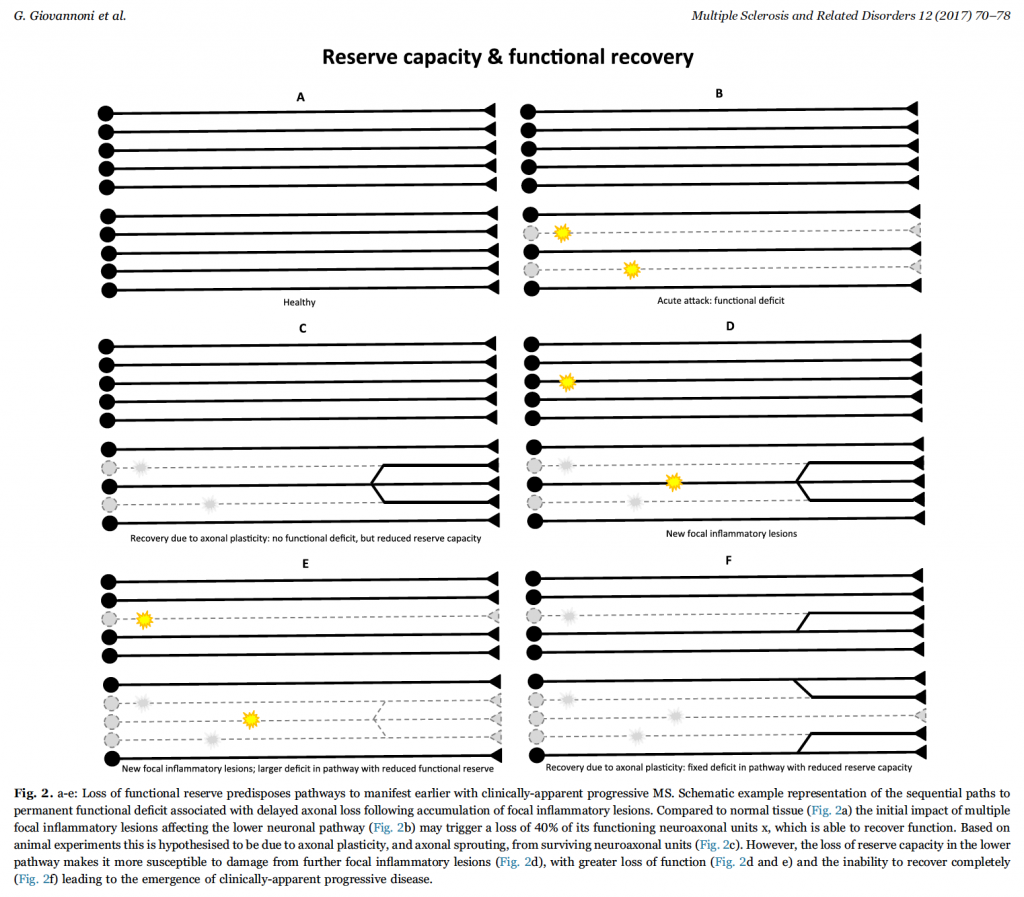
Diversi sistemi funzionali del Sistema Nervoso Centrale (SNC) hanno una propria “reserve capacity”, cui corrisponde una diversa riserva funzionale. Teoria ampiamente accettata è che un assone sopravvissuto ad un attacco infiammatorio focale è maggiormente sensibile a degenerare nel tempo. Tante più lesioni avrà accumulato tanto più sarà vulnerabile (Fig.1). Inoltre, in seguito ad una lesione infiammatoria focale, si instaurano fenomeni di plasticità assonale e di sprouting che permettono un recupero funzionale, cui corrisponde tuttavia una conseguente riduzione della “reserve capacity”. Tante più lesioni si accumulano tanto più si ridurrà la “reserve capacity” fino all’incapacità di recuperare da un danno funzionale. (Fig.2) Di fatto è all’esaurirsi di questi meccanismi volti a compensare la perdita assonale che la progressione di malattia diventa clinicamente evidente. Quindi la riserva funzionale e la capacità di recuperare parzialmente o totalmente da una lesione demielinizzante acuta rappresentano variabili che rendono difficilmente individuabile e, ancor di più, prevedibile la progressione nelle fasi precoci di malattia. Infine, è noto che alcune aree del SNC sono più frequentemente soggette al formarsi delle lesioni; questa evidenza è il risultato di studi anatomopatologici grossolani e di risonanza magnetica a basso campo. Più recenti evidenze anatomopatologiche e di risonanza ad alto campo mostrano come fino al 50 % del carico lesionale di un paziente SM è localizzabile nella sostanza grigia (sia corticale che sottocorticale) mettendo in discussione il dogma della SM come patologia esclusiva della sostanza bianca. La mancanza di una specificità anatomica aumenta la probabilità che le vie assonali più lunghe siano a maggior rischio di avere un carico lesionale maggiore rispetto alle vie brevi.
Partendo da queste preliminari considerazioni Giovannoni e colleghi in questa review si propongono di rivisitare l’idea di SM progressiva illustrando il concetto di assonopatia lunghezza- dipendente e asincrona.
Assonopatia lunghezza dipendente
“Tanto più è lunga una via assonale tanto maggiore è la probabilità che accumuli un numero di lesioni sufficiente ad esaurire la riserva funzionale” (Fig.1). In linea con questa ipotesi, le osservazioni cliniche suggeriscono che i domini neuronali con proiezioni assonali più lunghe più frequentemente vengono coinvolti precocemente nella fase clinicamente progressiva di malattia (funzioni sfinteriali > corticospinale arti inferiori > corticospinale arti superiori > tronco-encefalo > sistema visivo). Alla base della minore suscettibilità alla neurodegenerazione delle vie motorie deputate agli arti superiori rispetto a quelle degli arti inferiori contribuisce anche un altro fattore anatomico: la più piccola taglia delle unità motorie e, in proporzione, una più estesa area di proiezione corticale dell’arto superiore. Probabilmente anche il diverso fenotipo metabolico dei neuroni è implicato nell’asincronia delle manifestazioni progressive: gli assoni spinali hanno una ridotta espressione delle proteine mitocondriali coinvolte nella respirazione cellulare ed una ridotta capacità di ritenere il calcio. Queste differenze anatomiche e biochimiche sono state evidenziate per spiegare come il midollo sia più suscettibile ai processi di atrofia rispetto all’encefalo. In questo lavoro di Giovannoni e colleghi si mostra come l’ipotesi dell’assonopatia centrale lunghezza-dipendente sia sostenuta non solo da fattori anatomici e biochimici, ma anche guidata da eventi probabilistici stocastici che interagiscono con questi. Secondo tale modello tratti assonali brevi possono essere coinvolti casualmente in fase molto precoce, ma, allo stesso tempo, è piuttosto infrequente che questi si trovino coinvolti nelle fasi iniziali del decorso clinico progressivo perché più tardivamente accumuleranno una quantità di lesioni sufficienti ad esaurire la riserva funzionale.
Il paradosso sensorimotorio
Nelle fasi iniziali di malattia sono più frequenti le ri-esacerbazioni sensitive, mentre nelle fasi avanzate e progressive di malattia sono più frequenti quelle motorie. Analogamente i sintomi sensitivi hanno maggiore probabilità di andare incontro a recupero parziale o completo rispetto a quelli motori. Perché i sintomi sensitivi sarebbero più frequenti all’esordio se le lesioni si realizzano secondo un modello stocastico? E perché quelli motori avrebbero un recupero peggiore? La risposta alla prima domanda potrebbe esserci data dalla più bassa soglia sintomatica delle vie sensitive (queste da una prospettiva evoluzionistica hanno il compito, infatti, di “rilevare” con estrema sensibilità gli stimoli derivanti dal mondo esterno), ma anche da una maggiore estensione della corteccia sensitiva. Da quanto detto, una lesione piccola sarà molto più probabilmente sintomatica se si realizza in un sistema sensitivo piuttosto che se si realizza nel sistema motorio. Questo potrebbe quindi anche spiegare il perché è meno probabile che una recidiva motoria recuperi: infatti se per rendere sintomatica una lesione nel sistema motorio questa deve essere più grande rispetto a quanto basti per il sistema sensitivo, è chiaro che le lesioni sintomatiche nel sistema motorio saranno in media più grandi di quelle nel sistema sensitivo e quindi più difficili da riparare. In ultimo, piccole lesioni nel pathway motorio possono causare sintomi quando la riserva funzionale è esaurita e questo spiegherebbe perché tanto più progredisce la malattia tanto più diventano frequenti le relapse motorie.
Ipotesi della SM progressiva asincrona
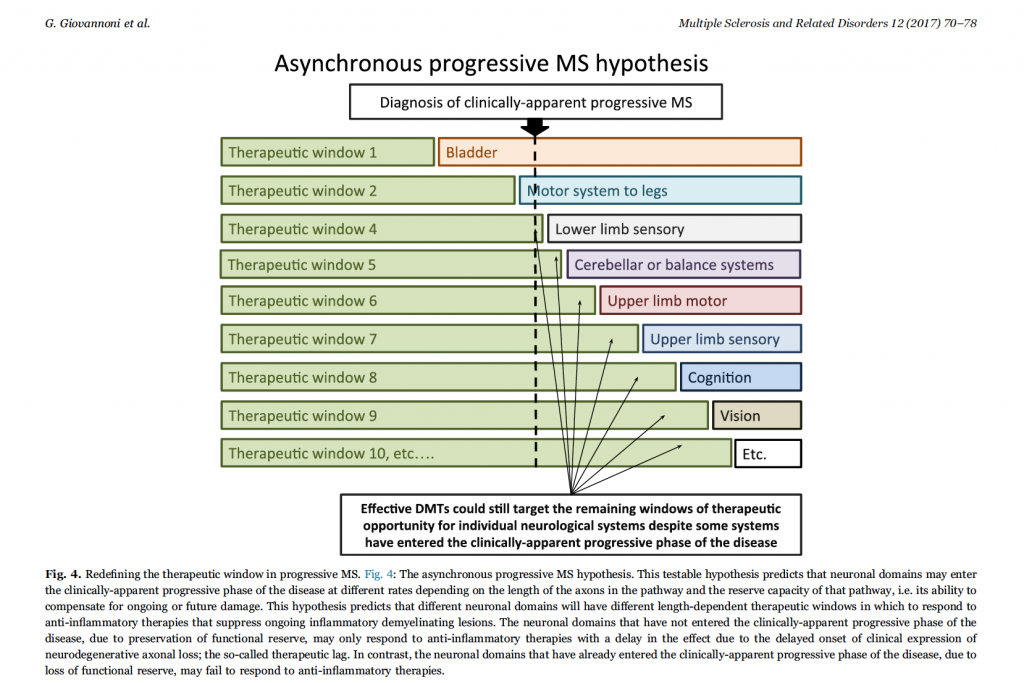
L’ipotesi che la neurodegenerazione possa seguire un modello lunghezza-dipendente potrebbe avere implicazioni importanti nel disegno di futuri trial clinici. Un dominio funzionale che ha esaurito la sua riserva funzionale (cioè ha accumulato un numero di lesioni sufficiente a comportare la degenerazione della via) difficilmente sarà suscettibile a terapie che agiscono sul meccanismo a monte (antiinfiammatorio/immunomodulante, come accade per tutte le disease modifing therapies, DMT). Parallelamente, però, domini che hanno ancora conservata parte della loro riserva funzionale potrebbero essere suscettibili a DMT in termini di protezione dalla neurodegenerazione. Quindi, pathways neuronali che hanno significativa riserva neuronale possono essere sensibili a fattori modificanti il decorso di malattia nonostante il paziente sia già entrato nella fase clinicamente progressiva in altri domini. A questo ci si riferisce con ipotesi della SM progressiva asincrona che propone come diversi domini funzionali possano avere finestre terapeutiche di durata diversa. Questa ipotesi spiega il perché quasi tutti i farmaci antiinfiammatori hanno fallito nei trial clinici sulla SM progressiva che come outcome primario hanno utilizzato il punteggio EDSS, soprattutto sopra il punteggio di 3,5 dove l’EDSS è prevalentemente una scala della deambulazione. Da qui il corollario dell’ipotesi della SM progressiva asincrona: i trial nei quali la maggior parte dei soggetti ha un EDSS elevato, misurato per un lasso di tempo breve, rileveranno, quasi esclusivamente, un peggioramento in quei sistemi funzionali che già hanno esaurito la riserva funzionale e che inesorabilmente degenereranno indipendentemente dalla terapia.
Therapeutic lag
Da quanto detto fino ad ora, una terapia che riduce la probabilità del formarsi di nuove lesioni potrebbe non avere alcun impatto clinicamente evidente sulla progressione della malattia per molti anni. Tuttavia sistemi neuronali con una riserva funzionale sufficientemente preservata potrebbero mostrare un therapeutic lag riguardo il momento in cui una data DMT impatterà sulle componenti della neurodegenerazione e sulla conseguente progressione clinica.
Il concetto del therapeutic lag nella SM progressiva è supportato dai risultati di uno studio randomizzato controllato placebo vs interferone-1b nella SM primariamente progressiva. Dopo 2 anni di osservazione nessuna differenza era rilevabile dal punto di vista clinico o di risonanza tra i due gruppi. Quando poi i pazienti sono stati rivalutati a distanza di 5 e 7 anni dall’interruzione dell’interferone e del placebo, significative differenze erano evidenti nelle misure cliniche e di risonanza (Fig. 3) Quindi, sopprimere l’infiammazione, e ridurre anche la probabilità del formarsi di nuove lesioni, nella SM progressiva potrebbe avere un impatto clinico dai 3 ai 7 anni dopo, quando la progressione, dovuta all’accumulo dei precedenti insulti infiammatori, dovrebbe oramai aver fatto il suo corso.
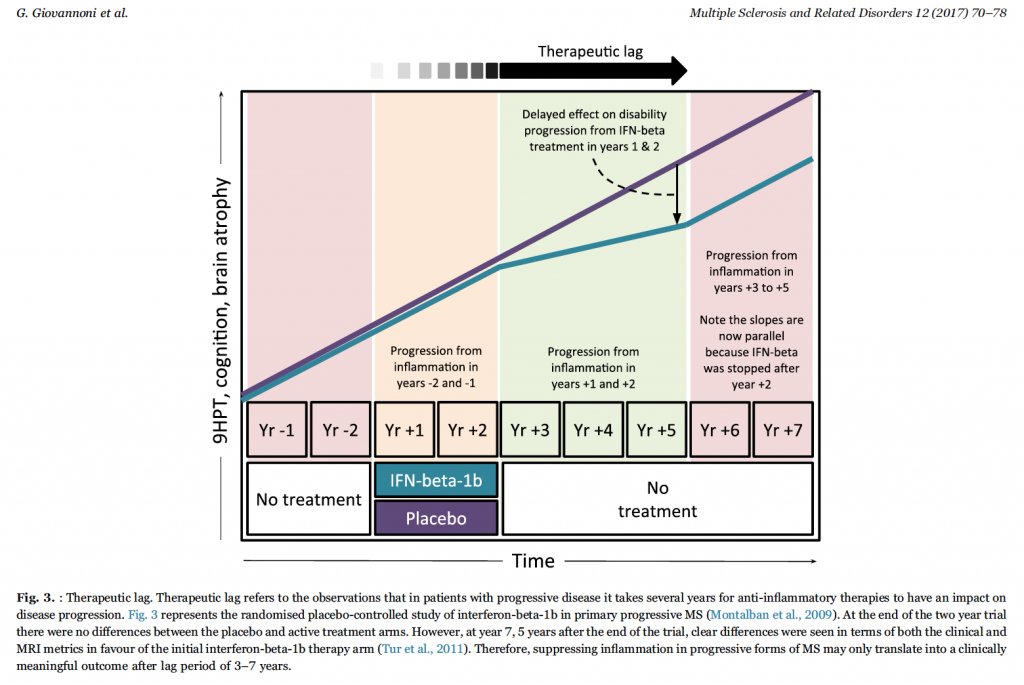
Conclusioni
Cosa significano per la SM progressiva, quindi, queste ipotesi? Se il therapeutic lag si confermasse questo potrebbe avere implicazione per la definizione della durata ottimale dei trial per SM progressiva: continuare a focalizzarsi sui domini funzionali anatomicamente sottesi da vie assonali più lunghe e che più velocemente esauriscono la loro riserva funzionale richiederebbe trial della durata di almeno 5 anni. Inoltre, se miriamo a trial che riescano ad individuare le diverse componenti fisiopatologiche della progressione dovremmo ripensare quali misure di outcome risultano più appropriate, ponendo la nostra attenzione su misure di progressione più sensibili e responsive, cioè corrispondenti a domini funzionali che conservano una sostanziale capacità di riserva nelle fasi precoci di malattia (arti superiori, cognitivo e visivo; Fig. 4). End-point compositi piuttosto che il solo EDSS potrebbero superare l’enfasi data alla disabilità motoria degli arti inferiori e potrebbero quindi essere più bilanciati verso domini con riserva funzionale conservata. Se l’ipotesi dell’assonopatia lunghezza dipendente dovesse essere vera, si può prevedere un’era di studi adattativi, in cui ad esempio le analisi di futilità vengano eseguite precocemente usando misure di esito che valutano domini neuronali con maggiore capacità di riserva dopo 2 anni e che, se positive, porteranno ad estendere lo studio per esaminare outcome corrispondenti a domini con capacità di riserva più limitata.
Gianmarco Abbadessa, Università della Campania Luigi Vanvitelli
gianmarcoabbadessa@live.com