È noto da tempo come gli eventi cerebrovascolari acuti, in particolare ictus ischemico ed emorragia cerebrale, siano fattori determinanti per l’instaurarsi di un processo infiammatorio a livello del sistema nervoso centrale. L’infiammazione focale da essi generata conduce ad un danno cerebrale secondario esacerbato da molteplici eventi, quali un danno della barriera ematoencefalica e al microcircolo, edema cerebrale, stress ossidativo e rilascio di mediatori infiammatori e patterns molecolari associati al danno (DAMPs), e culmina fino alla morte neuronale. Tale evento di tipo focale non fa che essere un trigger per un processo infiammatorio secondario più esteso a livello cerebrale, protratto nel tempo anche dopo il termine dell’insulto ischemico e che influenza l’outcome funzionale neurologico a lungo termine e aumenta il rischio per l’insorgenza di malattie cerebrovascolari croniche.

(Neuroinflammation: friend and foe for ischemic stroke. Jayaraj et al.)
Tuttavia la natura dell’infiammazione cerebrale prima e dopo lo stroke e le sue conseguenze a lungo termine non sono ancora del tutto comprese. Come noto dagli studi sul Covid-19, il processo infiammatorio può essere esso stesso un fattore scatenante per un danno vascolare acuto a causa di processi intravascolari e dell’invasione parenchimale da parte delle cellule infiammatorie. Tuttavia, molte delle cascate di segnalazione immunitaria inizialmente distruttive possono contribuire alla riparazione e al recupero attraverso la modulazione di segnali intercellulari appropriati.
Riconoscere quindi quanto la risposta del sistema immunitario durante un evento cerebrovascolare acuto non sia statica ma piuttosto variabile nel tempo è essenziale per il possibile sviluppo ed implementazione di strategie terapeutiche anti-infiammatorie utili nella prevenzione, cura e riparazione del danno vascolare cerebrale.
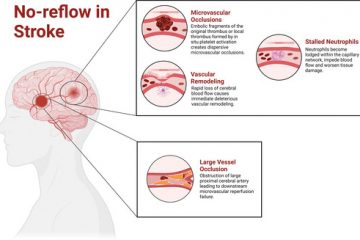
Nonostante i progressi nella terapia di ricanalizzazione per l’ictus ischemico acuto, alcuni pazienti non traggono beneficio dall’intervento precoce. Si ipotizza che il fenomeno del “no-reflow” sia un fattore significativo per gli esiti negativi dopo la recanalizzazione. Recenti evidenze indicano che il fenomeno del “no-reflow” è prevalentemente causato dall’accumulo di neutrofili. Alcuni modelli murini di ictus hanno mostrato miglioramenti degli esiti e riduzione dei volumi dell’infarto inducendo la neutropenia con un anticorpo monoclonale mirato. Inoltre, è emerso che le trappole extracellulari dei neutrofili (NETs) sono indotte dall’ictus e si accumulano nei tessuti peri-infartuali. L’inibizione delle NETs può promuovere il recupero funzionale post-ictus modulando la neovascolarizzazione. L’attivazione del sistema complemento funziona per eliminare cellule infette e patogeni dal sito di lesione. Gli studi hanno dimostrato il ruolo fondamentale del componente 3 del sistema complemento (C3) nell’ictus acuto, suggerendo che l’inibizione del recettore C3a potrebbe migliorare gli esiti neurologici in vari tipi di ictus in quanto svolge un ruolo critico nella riparazione e nel recupero dopo un ictus.
La terapia complementare più promettente, il B4Crry (anticorpo monoclonale murino con inibizione selettiva dell’infarto dell’attivazione del complemento C3), sembra dimostrare miglioramenti nella ricanalizzazione post-ictus quando somministrato con tPA (attivatore del plasminogeno di tipo tessutale), preservando nel contempo le funzioni cellulari di riparazione e recupero post-ictus. La somministrazione acuta di B4Crry sembra limitare l’infiammazione neurocronica e la neurodegenerazione senza influenzare la rimozione dei detriti delle cellule morte, fornendo un certo grado di neuroprotezione a lungo termine e riducendo probabilmente il rischio di progressione verso malattie cerebrovascolari croniche e compromissione cognitiva. Inoltre limita la deposizione perilesionale del complemento C3d, associato alla microgliosi.
Queste differenze nel mantenimento sinaptico post-ictus e nella microgliosi suggeriscono che la riduzione diffusa delle sinapsi e non la morte neuronale stessa possa essere la causa principale del declino cognitivo e dell’impairment post-ictus in questo modello.
Influenzare la reattività delle microglie residenti è stato considerato un potenziale obiettivo sia per lesioni cerebrovascolari acute che croniche. Ci sono prove che il fingolimod, che è stato studiato come potenziale coadiuvante alla terapia per l’ictus ischemico acuto, potrebbe influenzare la reattività delle microglie e promuovere processi rigenerativi. Inoltre, fattori di rischio vascolare cronici ben stabiliti, come l’ipertensione, la dislipidemia e il diabete, potrebbero promuovere una reattività microgliale proinfiammatoria anche in assenza di lesioni cerebrali acute. L’aggiunta post-ictus di terapia con statine ad alta intensità che, oltre al suo effetto ipocolesterolemizzante, potrebbe avere ampi effetti anti-infiammatori non specifici.
Gli effetti infiammatori delle microglie non sono limitati agli eventi ischemici. L’emorragia intracerebrale provoca significative risposte infiammatorie nel cervello a causa della morte dei tessuti e dell’extravasazione rapida di componenti intravascolari (ad esempio eritrociti) nel parenchima cerebrale. L’infiammazione periematomale è implicata nella fase secondaria di lesione che si verifica dopo l’emorragia iniziale. La risposta delle microglie locali che rispondono all’emorragia è regolata dalla segnalazione del TGF-β1 (fattore di crescita trasformante). La modulazione della risposta proinfiammatoria all’ICH attraverso la modulazione della segnalazione del TGF-β1 potrebbe essere una strategia anti-infiammatoria attraente per l’ICH.
Recentemente, la terapia con bexarotene mirata a migliorare la pulizia cellulare tempestiva tramite eritrofagocitosi da parte dei macrofagi dopo l’ICH ha dimostrato volumi ematoma più piccoli e migliori risultati funzionali. Pertanto, una strategia anti-infiammatoria nell’ICH potrebbe includere la juxtaposizione della riduzione della reattività microgliale proinfiammatoria attraverso le vie del TGF-β1 e la promozione della reattività microgliale rigenerativa per favorire il recupero.
Questa infiammazione post-ischemica potrebbe spiegare quindi le conseguenze cliniche ritardate dell’ictus acuto, tra cui l’impairment cognitivo post-ictus e la demenza. Ulteriori caratterizzazioni e comprensione dei processi infiammatori e immunitari nell’ictus sono necessari per sviluppare terapie mirate volte a contrastare le conseguenze dannose dell’infiammazione preservando importanti processi di riparazione.
Il danno cronico alla microcircolazione cerebrale è sempre più considerato come un fattore primario nell’insorgenza dell’impairment cognitivo e della demenza, nonché nell’aumento del rischio di ictus clinico. Vi è un fenomeno di retroazione positiva del danno cronico ai vasi cerebrali che alla fine porta a eventi trombo-occlusivi. Studi mostrano che i segnali infiammatori cronici sono associati al danno cerebrale da malattia dei vasi sanguigni di piccolo calibro e suggeriscono che un aumento sostenuto dell’infiammazione porti a una malattia cerebrovascolare progressiva. Inoltre, vari fattori infiammatori, tra cui il GDF-15 (fattore di crescita e differenziazione 15) e l’IL-18 (interleuchina-18), sono stati associati a un aumento del rischio di demenza e a danni alla sostanza bianca. L’IL-18 è stato recentemente dimostrato di ancorare una rete infiammatoria associata al danno ai vasi sanguigni cerebrali di piccolo calibro.

(“Inflammation and the Link to Vascular Brain Health: Timing Is Brain” Katherine T. Mun et all.)
Anche le infezioni sono da tempo considerate fattori scatenanti gli eventi cerebrovascolari, in particolare degli ictus ischemici. Infezioni pregresse, dalle comuni infezioni delle vie urinarie alle infezioni respiratorie pandemiche, aumentano il rischio di ictus. Le infezioni respiratorie virali aumentano il rischio di ictus ischemici per due motivi: molti virus respiratori hanno caratteristiche neurotropiche che portano a sequenze del sistema nervoso centrale e le infezioni virali respiratorie colpiscono direttamente il sistema polmonare, causando ipossiemia e aumentando lo stato infiammatorio sistemico indotto dall’infezione. Inoltre, sta emergendo l’evidenza che il sistema del complemento e il C3 possono essere fattori chiave dell’infiammazione cerebrovascolare e della trombosi nel COVID-19. Altre infezioni virali, come la varicella e l’HIV, possono invadere direttamente il sistema cerebrovascolare portando a dissezioni arteriose e complicazioni trombotiche.
Esiste una forte evidenza che, indipendentemente dal meccanismo patogenico, la vaccinazione riduca il rischio di ictus correlato all’infezione. La vaccinazione sembra ridurre il rischio sia prevenendo l’infezione sia attenuando le risposte infiammatorie sistemiche in caso di infezione.

(“Inflammation and the Link to Vascular Brain Health: Timing Is Brain” Katherine T. Mun et all.)
La crescente precisione nell’identificazione delle cascate infiammatorie sia nelle forme acute che croniche di malattie cerebrovascolari apre la porta a terapie mirate per specifiche sottopopolazioni di individui a rischio e durante diverse fasi della malattia cerebrovascolare. Mentre si attendono queste terapie mirate, gli attuali interventi per ridurre l’infiammazione possono essere implementati nella pratica clinica. A livello di popolazione, il rischio cardiovascolare e cerebrovascolare è aumentato negli individui con marcatori elevati di infiammazione, tra cui hsCRP, parzialmente guidato dall’aumento del segnale di IL-1beta. Il trattamento regolare a basso dosaggio con metotrexato nel trial CIRT non è stato efficace nel ridurre i livelli di IL-1β o hsCRP e non ha ridotto gli esiti cardiovascolari o cerebrovascolari. In contrasto, l’inizio del trattamento a basso dosaggio con colchicina nei pazienti dopo un infarto miocardico ha ridotto drasticamente il rischio di ictus, supportando il concetto di farmaci anti-infiammatori ad ampio spettro come strategia di riduzione del rischio per le malattie cerebrovascolari.
Il fingolimod sembra ridurre la perdita vascolare, forse arrestando una cascata retroattiva innescata dall’invasione dei leucociti. Questa strategia terapeutica potrebbe essere efficace anche nelle malattie della salute vascolare cerebrale a lungo termine, in cui la perdita vascolare cronica gioca un ruolo significativo, comprese le lesioni cerebrali indotte dall’ipertensione, le lesioni cerebrali traumatiche e le lesioni correlate all’infezione come quelle scatenate dal SARS-CoV-2.
Nella malattia cerebrovascolare cronica, l’inibizione costante a basso livello di particolari cascate del complemento potrebbe ridurre la trombosi microvascolare, la perdita della barriera emato-encefalica, o entrambe, riducendo così la progressione delle lesioni della sostanza bianca.
La natura fasica dei segnali infiammatori nell’ictus acuto crea una sfida significativa nell’individuare le finestre terapeutiche appropriate. I trattamenti anti-infiammatori possono offrire più promesse nel trattamento della malattia cerebrovascolare cronica, anche se il tempismo e l’identificazione appropriata del paziente saranno difficili da determinare. Fino a quando queste future terapie raggiungeranno la popolazione più ampia, il mantenimento della salute vascolare cerebrale dipenderà dall’individuo e dai suoi fornitori di assistenza nel seguire le ben consolidate misure preventive.
Questa nuova era probabilmente progredirà includendo terapie anti-infiammatorie potenti e specifiche utilizzate in modo fasicamente mirato a diverse popolazioni di pazienti in intervalli chiave prima e dopo l’ictus. Anche se infezione e infiammazione sono entrambe causa e conseguenza delle lesioni cerebrali vascolari, le loro conseguenze non devono essere necessariamente preordinate.
Laura Mancinelli
Università degli Studi di Trieste, Scuola di specializzazione in Neurologia
Bibliografia
- Iadecola C, Buckwalter MS, Anrather J. Immune responses to stroke: mechanisms, modulation, and therapeuticpotential. J Clin Invest. 2020;130:2777–2788. doi: 10.1172/JCI135530
- “Inflammation and the Link to Vascular Brain Health: Timing Is Brain” Katherine T. Mun , MD; Jason D. Hinman , MD, PhD. Stroke. 2022;53:427–436. DOI: 10.1161/STROKEAHA.121.032613
- Jayaraj et al. Journal of Neuroinflammation (2019) 16:142,https://doi.org/10.1186/s12974-019-1516-2, Neuroinflammation: friend and foe forischemic stroke.
- Global brain inflammation in stroke. Kaibin Shi et all. Lancet neurol 2019, July 8, 2019http://dx.doi.org/10.1016/S1474-4422(19)30078-X