Commento all’articolo di Sperring CP et al., No-Reflow Post-Recanalization in Acute Ischemic Stroke: Mechanisms, Measurements, and Molecular Markers. Stroke. 2023 Sep;54(9):2472-2480. doi: 10.1161/STROKEAHA.123.044240. Epub 2023 Aug 3. PMID: 37534511.
L’ictus ischemico acuto rappresenta la principale causa di disabilità in tutto il mondo. La trombolisi endovenosa seguita dalla trombectomia meccanica (TM) rappresenta il trattamento principale per la ricanalizzazione in caso di occlusione di grosso vaso. Circa la metà dei pazienti rivascolarizzati con successo non riacquista completamente l’indipendenza funzionale precedente all’ictus, e tale evento è stato definito come no-reflow phenomenon. In una recente review di Sperring CP e colleghi sono stati analizzati meccanismi, misurazioni e marcatori molecolari associati al no-reflow phenomenon nell’ictus ischemico acuto.
Potenziali meccanismi associati al no-reflow sono rappresentati in primis dall’occlusione del microcircolo da parte di frammenti embolici del trombo originale o di un trombo formatosi in situ. Coaguli più morbidi, spesso ricchi di eritrociti, hanno maggiori probabilità di migrare a valle durante la procedura di TM. Tali coaguli presentano tipicamente un’eziologia aterosclerotica, contrariamente ai coaguli di origine cardioembolica costituiti in gran parte da piastrine e fibrina. Durante l’ictus le giunzioni tra cellule epiteliali e cellule muscolari lisce vengono interrotte, con conseguente disregolazione del tono vascolare. Consegue una inibizione del rilascio di sostanze vasoattive come la prostaglandina E2, potente vasodilatatore, tuttavia risulta incrementato il rilascio di acido 20-idrossieicosatetraenoico, fattore vasocostrittore. Infine, la rottura precoce della barriera emato-encefalica ed il rilascio di fibrinogeno attivano la microglia locale. Dopo 24 ore dalla riperfusione, è stato dimostrato infatti che le cellule della microglia fagocitano le cellule epiteliali e rilasciano proteasi, innescando un’ulteriore alterazione a carico della barriera ematoencefalica. Anche i neutrofili contribuiscono al fenomeno del no-reflow, a causa del loro depositarsi all’interno della rete capillare, impedendo il flusso sanguigno e peggiorando il danno tissutale.
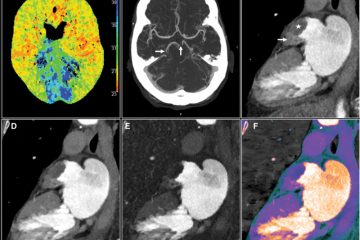
Per quantificare indirettamente il fenomeno del no-reflow è stata utilizzata la scala Rankin modificata (mRS), nei soggetti con punteggi alla scala “Thrombolysis in Cerebral Infarction” (TICI) o TICI modificata (mTICI) di 2b o 2c, classificando come riperfusione futile punteggi mRS di almeno 3. Tuttavia multipli fattori possono contribuire ad un incremento del punteggio mRS post evento ischemico, pertanto è stato incoraggiato l’utilizzo di score di neuroimaging come l’ “Alberta Stroke Programme Early CT Score (ASPECTS), definendo come buon outcomeunpunteggio di almeno 8. Grazie all’utilizzo del Doppler transcranico invece, è stato evidenziato come un indice di pulsatilità elevato dell’arteria cerebrale media, marcatore di resistenza microvascolare, sia associato a punteggi mRS più alti. La risonanza magnetica (RM) di perfusione è stata utilizzata per determinare il tempo di transito medio ovvero il tempo che impiega il flusso ematico ad attraversare i vasi cerebrali, tuttavia sebbene le tecniche basate sulla RM forniscano informazioni preziose, non valutano direttamente la riperfusione. Pertanto diversi gruppi di studio hanno esplorato l’utilizzo di modalità di imaging meno convenzionali come il “laser speckle contrast imaging” (LSCI), tecnica utilizzata per misurare il flusso ematico. In alternativa al neuroimaging, alcuni studi preclinici tramite l’istopatologia hanno cercato di valutare la riperfusione, ad esempio marchiando con la lectina il sistema vascolare di fette di encefalo di ratto per determinare la pervietà dei vasi tramite microscopia confocale, oppure utilizzando la colorazione con ematossilina ed eosina.
Sia per scopi clinici che scientifici, è necessario identificare marcatori molecolari prognostici per il fenomeno del no-reflow. Numerosi studi hanno dimostrato che un incremento del numero di neutrofili è associato ad un outcome clinico sfavorevole, definito come punteggio mRS a 90 giorni dopo l’ictus superiore o uguale a 3; inoltre questo parametro si associa ad elevati punteggi NIHSS (National Institutes of Health Stroke Score) a 72 ore dall’evento. L’introduzione dell’anti-Ly6G, un anticorpo monoclonale anti-neutrofili, ha incrementato significativamente la riperfusione, sottolineando il ruolo potenziale dei neutrofili in questo fenomeno. Diversi gruppi di studio hanno valutato anche il rapporto neutrofili/linfociti come indicatore prognostico, documentando che un rapporto più basso, da 3 a 7 giorni dopo l’ictus, è associato ad una riperfusione riuscita dopo TM (valutata con la scala mTICI); viceversa, un incremento di tale rapporto è indicativo di scarsa riperfusione. E’ stato inoltre esplorato il ruolo prognostico di molecole proinfiammatorie, in particolare l’interleuchina-6 (IL-6), evidenziando come bassi livelli di IL-6 periferica siano associati ad una riperfusione completa (mTICI 2c o 3) dopo una singola TM. Anche un incremento dell’ IL-1 è associata ad una riduzione significativa del flusso ematico cerebrale e ad incremento del volume dell’infarto. Oltre a tali molecole proinfiammatorie, ulteriori potenziali fattori prognostici sono rappresentati da: un’elevata glicemia, un incremento della proteina acida fibrillare gliale, della tau totale e della catena leggera del neurofilamento ed elevati livelli sistemici di CXCL-11 (C-X-C motif chemokine ligand 11). Infine modelli animali sono stati utilizzati per identificare geni e fattori sistemici che possano contribuire al danno ischemico come le selectine P ed E, le quali risultano elevate sia a livello della circolazione cerebrale sia periferica. Infine anche lo stress ossidativo-nitrativo contribuisce alla contrazione dei periciti e alla costrizione capillare.
Nonostante la mancanza di tecniche di misurazione accettate e di marcatori prognostici definiti, sono in corso studi su diversi trattamenti volti a migliorare la riperfusione microvascolare dopo TM, come la somministrazione aggiuntiva di alteplase intrarterioso dopo TM riuscita, dimostrando che i pazienti trattati con una dose aggiuntiva di farmaco hanno una maggiore probabilità di avere un punteggio mRS pari a 0 o 1 a 90 giorni rispetto al gruppo di controllo.
Pertanto futuri studi sono necessari per poter definire tecniche di misurazione e marcatori prognostici adeguati, in modo tale da poter utilizzare anche nuovi protocolli terapeutici per i pazienti con un aumentato rischio di no-reflow dopo ricanalizzazione.
Debora Galotto
Dipartimento di Biomedicina Traslazionale e Neuroscenze (DiBraiN), Università “Aldo Moro” di Bari
galottodebora@libero.it