Gli immune-checkpoint inhibitors (ICIs) rappresentano una nuova classe di farmaci che ha rivoluzionato il trattamento di diverse neoplasie negli ultimi anni (1). Si tratta di anticorpi monoclonali che antagonizzano molecole implicate in vie di segnalazione inibitorie sui linfociti T.
Questi pathways che sono normalmente coinvolti nella prevenzione dell’autoimmunità possono venire attivati in maniera aberrante dalle cellule tumorali per sfuggire al controllo immunitario; questi farmaci permettono lo sblocco della risposta immune del paziente verso il tumore. Gli ICIs hanno recentemente dimostrato una marcata efficacia in diversi tipi di tumore in stadio avanzato, portando a frequenti risposte sostenute nel tempo. Le classi di ICI attualmente approvate in Europa ed USA antagonizzano le vie di segnalazione di CTLA-4 e PD-1/PDL-1 (1):

Purtroppo, il beneficio oncologico é controbilanciato in molti pazienti dalla comparsa di una risposta immunitaria verso il self, che può essere di diversa entità e gravità. Gli effetti avversi immunorelati (o irAEs, immune-related adverse events, come indicati nella letteratura specifica) più frequenti riguardano la cute, l’apparato gastrointestinale, il fegato e l’apparato endocrino e sono perlopiù gestibili con basse dosi di corticosteroidi (2). Tossicità più rare, quale ad esempio la miocardite,
possono essere particolarmente severe e refrattarie ai trattamenti, con una letalità fino al 30-50%.
Le tossicità neurologiche da ICIs sono eventi avversi rari ma particolarmente temuti per la loro potenziale morbidità e mortalità. L’incidenza di tossicità neurologiche severe è stimata 0.5-1% per i farmaci anti-PD1/PDL1, 0.7-2.2% per gli anti-CTLA4 e 0.7-4.7% per le terapie di combinazione (anti- PD1/PDL1 + anti-CTLA4).
La diagnosi e la gestione di queste patologie rappresenta una sfida per il neurologo, in quanto si presentano in pazienti oncologici complessi, in cui diagnosi alternative (tumorale in primis, ma anche infettiva, paraneoplastica, metabolico-carenziale) devono essere accuratamente escluse. Sebbene infatti segni di infiammazione alle indagini strumentali e di laboratorio (ad es., su liquor) possono essere considerati come supportive dell’eziologia ICI-relata, questa resta una diagnosi di esclusione. Il
rapporto temporale con l’esposizione al farmaco appare il fattore più indicativo; gli eventi avversi neurologici esordiscono più frequentemente dopo 1-3 cicli di terapia, anche se possono comparire dopo svariati mesi di trattamento. Inoltre, nonostante le forme di tossicità neurologiche da ICI
possano essere ricondotte alle principali sindromi del Sistema Nervoso Centrale o Periferico, queste presentano importanti peculiarità nella presentazione clinica, evoluzione e risposta ai trattamenti che devono essere conosciute per una corretta gestione e trattamento del paziente (3).
Gli eventi avversi neurologici da ICI interessano principalmente le strutture neuromuscolari, sotto forma di miosite, miastenia, poliradicolonevrite o polineuropatia (4). L’interessamento del SNC appare meno comune.
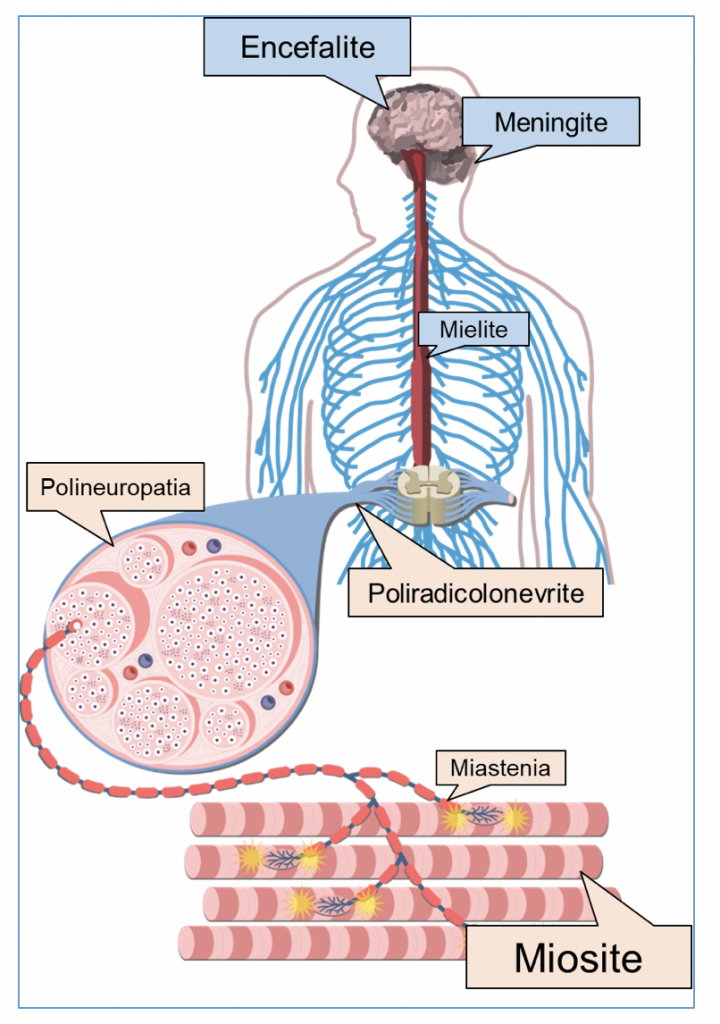
La miosite, in particolare, è emersa come la più rilevante tossicità neuromuscolare da checkpoint inhibitors (5,6). Si presenta con sintomi classici quali mialgie, deficit stenico prossimale, ma anche con il frequente e precoce interessamento di altri distretti, quale quello oculare (diplopia, ptosi), bulbare (disfagia), ed assiale (frequentemente con testa cadente, o head drop), che possono mimare un esordio di miastenia. Molti casi in letteratura sono stati riportati inizialmente come forme di miastenia; tuttavia, se estensivamente studiati, quasi tutti i pazienti presentano segni di danno muscolare (incremento delle CPK, pattern miopatici all’EMG, alterazioni alla RMN muscolare). Segni di alterata funzionalità della placca neuromuscolare sono dimostrabili invece solo in una piccola parte dei pazienti. La presenza di un titolo significativo di autoanticorpi anti-AChR da sola non giustifica la diagnosi di miastenia, in quanto questi possono essere preesistenti ed anzi è stato recentemente dimostrato che la loro positività pretrattamento con ICI è associata ad un aumentato rischio di sviluppare miosite (7). L’aspetto istopatologico è infatti quello di una miosite necrotizzante multifocale, con infiltrati linfocitari T e macrofagici; l’aspetto focale della malattia può essere causa di falsi negativi allo studio EMG ed anche bioptico. Il corretto inquadramento di una miosite da ICI è di particolare importanza in quanto il processo infiammatorio può estendersi nel 30-40% dei pazienti al miocardio, con miocardite, alterazioni del ritmo e rischio di morte improvvisa, ed al diaframma, con insufficienza respiratoria fatale. Una precoce diagnosi è pertanto necessaria per la corretta sorveglianza del paziente e la tempestiva introduzione di trattamenti adeguati.
Altre tossicità periferiche da ICI possono essere la poliradicolonevrite (simile alla sindrome di Guillain-Barré “classica”, seppur con alcune differenze quali una presentazione più frequentemente subacuta, la presenza di pleocitosi linfocitica all’esame del liquor, e la risposta ai corticosteroidi) e le polineuropatie (con pattern demielinizzante ma anche prevalentemente assonale o misto, e frequente interessamento delle fibre autonomiche) (4,8). La risposta disimmune può interessare come già detto anche il SNC, sotto diverse forme (encefalite, meningite, mielite). L’interessamento meningo-encefalitico appare il più rilevante per frequenza e severità, e può variare da forme di meningite asettica senza un interessamento dimostrabile del parenchima cerebrale a forme di encefalite limbica, meningoencefalite diffusa, cerebellite (9,10).
Benché la maggior parte dei casi risultino sieronegativi per anticorpi anti-SNC, numerosi casi di positività per anticorpi onconeurali, contro antigeni di superficie ed antigeni astrocitari sono stati riportati; il loro ruolo è tuttavia ancora parzialmente incompreso negli eventi avversi ICI-relati,
prevalentemente legati all’immunità T cellulare. È infatti tuttora in corso il dibattito sulla precisa eziopatogenesi della tossicità immuno-relata da ICI
(neurologica e non); in particolare appare dibattuto se la risposta autoimmune aberrante si sviluppi in seguito all’esposizione al farmaco o se questa sia già presente in forma subclinica in una percentuale di pazienti neoplastici, mantenuta “a freno” dal corretto funzionamento degli immune
checkpoint. A favore di quest’ultima ipotesi appaiono il timing di insorgenza degli eventi avversi, in molti casi troppo breve per montare una risposta immunitaria “de novo”, e soprattutto alcuni recenti lavori, i quali hanno dimostrato la preesistenza di anticorpi contro antigeni neurali pretrattamento in pazienti che hanno sviluppato in seguito tossicità neurologiche (7,11); in particolare, il già citato studio di Mammen e colleghi su una piccola coorte di pazienti trattati con anti-PDL1 per neoplasie
timiche ha mostrato la positività per anticorpi anti AChR in oltre la metà dei casi (in assenza di storia clinica di miastenia); tutti i pazienti con titolo anticorpale anti AChR positivo pretrattamento hanno sviluppato miosite in seguito al trattamento con ICI, contro nessuno dei pazienti con titolo
anticorpale negativo (7). Ulteriori studi sono in corso in differenti centri al fine di caratterizzare i marcatori più efficaci di predisposizione allo sviluppo di tossicità. Il trattamento di prima linea di tutti gli eventi avversi neurologici immuno-relati consiste nella somministrazione di steroidi ad alte dosi (12,13), anche in forme considerate tradizionalmente non
responsive ai corticosteroidi (ad esempio la poliradicolonevrite acuta). Nei casi corticoresistenti, o in prima linea nelle forme più severe, vengono solitamente utilizzate la plasmaferesi o le IVIg. Poiché i checkpoint inhibitors presentano una lunga emivita, è necessario uno scalo molto lento dei corticosteroidi (almeno 2-3 mesi); una diminuzione troppo rapida si associa ad un aumentato rischio di recidiva dei sintomi (14).
La percentuale di pazienti neoplastici, mantenuta “a freno” dal corretto funzionamento degli immune checkpoint. A favore di quest’ultima ipotesi appaiono il timing di insorgenza degli eventi avversi, in molti casi troppo breve per montare una risposta immunitaria “de novo”, e soprattutto alcuni recenti lavori, i quali hanno dimostrato la preesistenza di anticorpi contro antigeni neurali pretrattamento in pazienti che hanno sviluppato in seguito tossicità neurologiche (7,11); in particolare, il già citato
studio di Mammen e colleghi su una piccola coorte di pazienti trattati con anti-PDL1 per neoplasie timiche ha mostrato la positività per anticorpi anti AChR in oltre la metà dei casi (in assenza di storia clinica di miastenia); tutti i pazienti con titolo anticorpale anti AChR positivo pretrattamento hanno sviluppato miosite in seguito al trattamento con ICI, contro nessuno dei pazienti con titolo anticorpale negativo (7). Ulteriori studi sono in corso in differenti centri al fine di caratterizzare i
marcatori più efficaci di predisposizione allo sviluppo di tossicità.
Il trattamento di prima linea di tutti gli eventi avversi neurologici immuno-relati consiste nella somministrazione di steroidi ad alte dosi (12,13), anche in forme considerate tradizionalmente non responsive ai corticosteroidi (ad esempio la poliradicolonevrite acuta). Nei casi corticoresistenti, o in prima linea nelle forme più severe, vengono solitamente utilizzate la plasmaferesi o le IVIg. Poiché i checkpoint inhibitors presentano una lunga emivita, è necessario uno scalo molto lento dei corticosteroidi (almeno 2-3 mesi); una diminuzione troppo rapida si associa ad un aumentato rischio di recidiva dei sintomi (14).
Tuttavia, l’impatto dell’uso di terapie immunodepressive quali i corticosteroidi sull’efficacia oncologica degli ICI è poco caratterizzato; studi hanno suggerito una possibile riduzione dell’attività antineoplastica, cui si associano i noti effetti collaterali sistemici della terapia corticosteroidea. Alcuni Autori hanno pertanto suggerito un approccio personalizzato con terapie immunomodulanti mirate ai meccanismi che si suppongono sottostanti alla disimmunità in atto (15); un esempio è dato dal recente trattamento di un caso di encefalite ICI-relata con natalizumab, che, bloccando la migrazione dei linfociti T patologici attraverso la barriera ematoencefalica non impatta, in linea almeno teorica, l’efficacia antitumorale dei checkpoint inhibitors (16). Altri esempi di terapie mirate sono l’uso dell’agonista CTLA4 abatacept nel trattamento di un caso severo di miosite e miocardite da anti-PD1 (17) e dell’anti-TNFα infliximab in un paziente con mielite (18).
L’Associazione Italiana di Oncologia Medica ha pubblicato recentemente la prima versione delle Linee Guida italiane sulla gestione delle tossicità da immunoterapia, comprese le tossicità neurologiche
(https://www.aiom.it/wp-content/uploads/2019/10/2019_LG_AIOM_Toss_Immunoterapia.pdf).
All’interno del Gruppo di Studio di Neuro-Oncologia della SIN è in corso una raccolta dati multicentrica di casi di tossicità neurologica in corso di trattamento con ICI. L’inserimento dei dati può essere liberamente fatto da qualsiasi neurologo che diagnostichi una complicanza neurologica da
ICIs. Al momento la casistica ha raccolto oltre 25 casi di tossicità.
Il progetto può essere visionato al
link: http://www.neuro.it/web/eventi/NEURO/gruppi.cfm?p=NEURO_ONCOLOGIA I contatti per la segnalazione di nuovi casi sono: luca.diamanti@mondino.it oppure enrico.marchioni@mondino.it
oppure picca.alberto@gmail.com
Picca Alberto
Specializzando in Neurologia, Università di Pavia
BIBLIOGRAFIA
1. Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade. Science. 2018;359(6382):1350–5.
2. Postow MA, Sidlow R, Hellmann MD. Immune-Related Adverse Events Associated with Immune Checkpoint Blockade. N Engl J Med. 2018;378(2):158-168.
3. Touat M, Talmasov D, Ricard D, Psimaras D. Neurological toxicities associated with immune-checkpoint inhibitors. Curr Opin Neurol. 2017;30(6):659–68.
4. Psimaras D, Velasco R, Birzu C, Tamburin S, Lustberg M, Bruna J, et al. Immune checkpoint inhibitors-induced neuromuscular toxicity: From pathogenesis to treatment. J Peripher Nerv Syst. 2019;24 Suppl 2:S74–85.
5. Touat M, Maisonobe T, Knauss S, Ben Hadj Salem O, Hervier B, Auré K, et al. Immune checkpoint inhibitor-related myositis and myocarditis in patients with cancer. Neurology. 04 2018;91(10):e985–94.
6. Seki M, Uruha A, Ohnuki Y, Kamada S, Noda T, Onda A, et al. Inflammatory myopathy associated with PD-1 inhibitors. J Autoimmun. 2019;100:105–13.
7. Mammen AL, Rajan A, Pak K, Lehky T, Casciola-Rosen L, Donahue RN, et al. Pre-existing antiacetylcholine receptor autoantibodies and B cell lymphopaenia are associated with the development of myositis in patients with thymoma treated with avelumab, an immune checkpoint inhibitor targeting programmed death-ligand 1. Ann Rheum Dis. 2019;78(1):150–2.
8. Chen X, Haggiagi A, Tzatha E, DeAngelis LM, Santomasso B. Electrophysiological findings in immune checkpoint inhibitor-related peripheral neuropathy. Clin Neurophysiol. 2019;130(8):1440–5.
9. Williams TJ, Benavides DR, Patrice K-A, Dalmau JO, de Ávila ALR, Le DT, et al. Association of Autoimmune Encephalitis With Combined Immune Checkpoint Inhibitor Treatment for Metastatic Cancer. JAMA Neurol. 2016;73(8):928–33.
10. Vogrig A, Muñiz-Castrillo S, Joubert B, Picard G, Rogemond V, Marchal C, et al. Central nervous system complications associated with immune checkpoint inhibitors. J Neurol Neurosurg Psychiatry. 2020;91(7):772–8.
11. Sechi E, Markovic SN, McKeon A, Dubey D, Liewluck T, Lennon VA, et al. Neurological autoimmunity and immune checkpoint inhibitors: Autoantibody profiles and outcomes. [published online ahead of print, 2020 Aug 13]. Neurology. 2020;10.1212/WNL.0000000000010632.
12. Haanen JBAG, Carbonnel F, Robert C, Kerr KM, Peters S, Larkin J, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28:iv119–42.
13. Brahmer JR, Lacchetti C, Schneider BJ, Atkins MB, Brassil KJ, Caterino JM, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 10 2018;36(17):1714–68.
14. Bruna J, Argyriou AA, Anastopoulou GG, Alemany M, Nadal E, Kalofonou F, et al. Incidence and characteristics of neurotoxicity in immune checkpoint inhibitors with focus on neuromuscular events: Experience beyond the clinical trials. J Peripher Nerv Syst. 2020;25(2):171–7.
15. Esfahani K, Elkrief A, Calabrese C, Lapointe R, Hudson M, Routy B, et al. Moving towards personalized treatments of immune-related adverse events. Nat Rev Clin Oncol. 2020;17(8):504–15.
16. Hottinger AF, de Micheli R, Guido V, Karampera A, Hagmann P, Du Pasquier R. Natalizumab may control immune checkpoint inhibitor–induced limbic encephalitis. Neurol – Neuroimmunol Neuroinflammation. 2018;5(2):e439.
17. Salem J-E, Allenbach Y, Vozy A, Brechot N, Johnson DB, Moslehi JJ, et al. Abatacept for Severe Immune Checkpoint Inhibitor–Associated Myocarditis. N Engl J Med. 2019;380(24):2377–9.
18. Chang VA, Simpson DR, Daniels GA, Piccioni DE. Infliximab for treatment-refractory transverse myelitis following immune therapy and radiation. J Immunother Cancer. 2018;6(1):153.