La malattia cerebrovascolare è ancora oggi un’importante causa di mortalità e disabilità in tutto il mondo. Con il passare degli anni sono state apportate diverse modifiche in campo assistenziale, al fine di perseguire come obiettivo l’ottimizzazione degli outcomes terapeutici e funzionali nei pazienti affetti da eventi cerebrovascolari.
In campo diagnostico-terapeutico gli studi e la ricerca, attraverso l’introduzione di metodiche di neuro-imaging avanzate (RM con sequenze DWI/PWI e TC di perfusione), hanno permesso l’estensione della finestra terapeutica ad una coorte sempre più ampia di pazienti. La trombolisi (intravenous trombolysis – IVT) e la trombectomia meccanica (meccanica trombolysis – MT) rappresentano ad oggi i due capisaldi del trattamento dell’ictus ischemico acuto.
Generalmente la scelta tra le due opzioni terapeutiche si basa su:
- finestra terapeutica
- modalità d’esordio
- distretto vascolare interessato
- controindicazioni alla procedura in esame
- esperienza dei gruppi di ricerca
A volte l’applicazione di un’unica metodica potrebbe non essere sufficiente per ottenere il risultato desiderato; infatti, vi sono circostanze in cui si rende necessario l’utilizzo di entrambi i tipi di trattamento.
Questo è quello che accade ad esempio negli stroke di circolo anteriore, che sono spesso causati dall’occlusione di un grosso vaso (large vessel occlusion – LVO).
Quando parliamo di LVO facciamo riferimento a blocchi della circolazione intracranica prossimale anteriore e posteriore. Questi quadri rappresentano circa il 24-46% degli ictus ischemici acuti. Tali forme di stroke erano inizialmente descritte solo per l’arteria carotidea interna (Internal Carotid Artery – ICA) e il tratto prossimale dell’arteria cerebrale media (M1), successivamente questa definizione è stata estesa anche a blocchi del tratto più distale rispetto a M1 (M2), all’arteria cerebrale anteriore nei tratti A1, A2 e al distretto posteriore, ovvero al tratto intracranico dell’arteria vertebrale (Vertebral Artery – VA), al tratto prossimale dell’ arteria cerebrale posteriore (P1) e all’arteria basilare (Basilar Artery – BA ).
Attualmente le ultime Linee Guida ESO 2019 [1] e ESO 2021 [2], rispettivamente la prima per la trombectomia e la seconda per la trombolisi, suggeriscono la combinazione (Bridging) delle due metodiche nel caso di ictus da LVO in circolo anteriore, ovvero:
Recentemente diversi studi controllati randomizzati (Randomized Controlled Trial – RCT) hanno valutato la possibile non inferiorità della trombectomia diretta rispetto alla Bridging Therapy nell’ictus da LVO in circolo anteriore.
Il gruppo di ricerca ESO-ESMINT ha analizzato 6 RCT che si sono proposti di studiare la non inferiorità della MT vs Bridging therapy. Di questi solo 2 RCT hanno presentato dati suggestivi per l’outcome sopracitato.
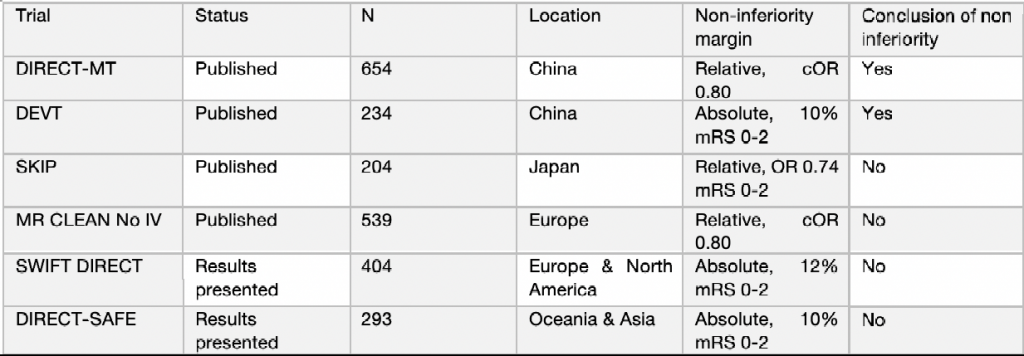
Il gruppo di ricerca ESO-ESMINT, per valutare la non-inferiorità, poneva come oggetto di analisi due PICO questions (Population/Patient/Problem, Intervention, Comparison, Outcome):
- Non inferiorità di MT vs Bridging nel modello operativo Mothership (trombolisi e trombectomia erogati nella medesima struttura)
- Non inferiorità di MT vs bridging nel modello operativo Drift and Ship (trombolisi nel centro più vicino e poi paziente inviato presso centro abilitato a trombectomia)
Per entrambe le PICO questions sono stati analizzati 3 aspetti:
a) proporzione di pazienti con buon esito (mRS 0-2) a 90 giorni
b) risultati non inferiori o migliori su altri indicatori di efficacia (intero range della mRS; mRS 0-1; riperfusione riuscita)
c) riduzione del rischio di eventi avversi (mortalità a 90 giorni, emorragia intracranica)
Il margine di non-inferiorità stabilito dalla commissione era di 1.3% (1.0% – 5.0%).
Gli studi randomizzati in esame includevano solo:
- pazienti con ictus da occlusione di grandi vasi del circolo anteriore
- idonei per terapia con alteplase entro 4,5 ore dall’esordio dei sintomi
- ricoverati in un centro abilitato alla trombectomia
La bridging therapy ha riportato risultati superiori sull’outcome funzionale (mRS [0-2] a 90 giorni) e la riduzione della disabilità residuale. Per la mortalità a 90 giorni i risultati erano simili.
Per quanto riguarda il successo della riperfusione (che corrisponde al ripristino di un flusso di almeno il 50% del territorio vascolare interessato dal vaso occluso alla fine della procedura endovascolare) la bridging therapy è risultata statisticamente superiore rispetto alla diretta MT.
Per le complicanze, l’analisi del rischio di incorrere nell’insorgenza di emorragie intracraniche sintomatiche è risultata minore con la MT diretta. Questo dato, però, non ha raggiunto la significatività statistica.
Se invece si considera il rischio di insorgenza di qualsiasi tipo di emorragia intracranica, MT diretta ha mostrato una differenza significativa presentando un minor rischio di insorgenza.
A seguito dell’analisi delle due PICO questions non è stato dunque possibile constatare la “non inferiorità” della trombectomia diretta.
Pertanto, in assenza di controindicazione, si consiglia la IVT prima della MT.
L’IVT non dovrebbe ritardare la MT o il trasferimento in un centro dotato di strutture dove si effettua la MT.
Di seguito vengono descritte le raccomandazioni del gruppo di ricerca.
- Nel modello Mothership:
Per i pazienti ricoverati direttamente in un centro abilitato alla trombectomia per un ictus ischemico acuto (≤ 4,5 ore dall’esordio dei sintomi) con occlusione di un grande vaso del circolo anteriore e che sono idonei per entrambi i trattamenti, si consiglia la trombolisi endovenosa più trombectomia meccanica rispetto alla sola trombectomia meccanica (qualità dell’evidenza = moderata; forza della raccomandazione = forte).
Entrambi i trattamenti devono essere eseguiti il prima possibile dopo l’arrivo in ospedale.
- Nel modello Drift and ship:
Per i pazienti ricoverati in un centro non abilitato alla trombectomia per un ictus ischemico acuto (≤ 4,5 ore dall’esordio dei sintomi) con occlusione di un grande vaso del circolo anteriore e che sono eleggibili per entrambi i trattamenti, si consiglia la trombolisi endovenosa seguita da un rapido trasferimento in un centro con strutture per la trombectomia, o nel caso di controindicazioni assolute alla trombolisi si consiglia il trasferimento in un centro abilitato per la trombectomia (qualità dell’evidenza = bassa; forza della raccomandazione = forte).
Nel caso di stroke al risveglio, per entrambi i modelli:
Per i pazienti ricoverati in un centro abilitato/non abilitato a trombectomia entro 4,5 ore dal riconoscimento dei sintomi dopo ictus al risveglio, causato dall’occlusione di vasi di grandi dimensioni del circolo anteriore, si suggerisce la trombolisi endovenosa più la trombectomia meccanica rispetto alla sola trombectomia meccanica in pazienti selezionati.
I criteri di selezione sono descritti nelle Linee Guida Europee [1], in particolare i criteri di imaging di ammissibilità per IVT includono la mancata corrispondenza DWI-FLAIR o la mancata corrispondenza nucleo di perfusione/penombra.
Pertanto, è importante ricordare che:
- la trombectomia meccanica non deve ostacolare l’inizio della trombolisi endovenosa
- la trombolisi endovenosa non deve ritardare la trombectomia meccanica
- la trombolisi endovenosa non dovrebbe ritardare il trasferimento in un centro dotato di strutture per la trombectomia
Alla luce di questi dati possiamo assumere che entrambe le scelte terapeutiche presentano rispettivamente dei punti di forza:
A favore della MT diretta (solo MT):
- la IVT è associata a bassi tassi di riperfusione riuscita prima della MT
- rischio minore di emorragia intracranica
- frammentazione del trombo
- la Bridging può ritardare MT
- ridotti costi sostanziali
A favore della bridging:
- una minoranza di pazienti con LVO ricanalizza precocemente con IVT
- l’IVT può migliorare il tasso di riperfusione riuscita dopo MT
- meno tentativi di ricanalizzazione
- può ridurre la trombosi microvascolare
- utile nei pazienti con MT senza successo (rescue trombolysis)
Secondo il gruppo di ricerca, il motivo per cui gli outcomes sono più favorevoli nella Bridging potrebbero dipendere dal suo effetto sul microcircolo, oltre alla possibilità di poter trattare con la trombolisi il paziente prima della procedura endovascolare.
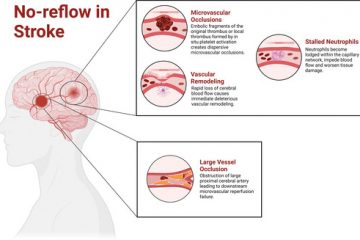
A volte, nonostante l’intervento repentino e il raggiungimento di una corretta riperfusione macrovascolare, non si ottiene il risultato sperato e questo potrebbe dipendere da un meccanismo vascolare chiamato “No Reflow”.
Piccola parentesi sul No reflow
Il “no reflow” è un fenomeno caratterizzato da un’ostruzione microvascolare dovuta alla riperfusione. Tale fenomeno sembrerebbe essere legato anche ad una predisposizione individuale.
Descritto in cardiologia nell’ambito del trattamento della patologia ischemica miocardica mediante procedure endovascolari, in realtà, questo fenomeno era stato inizialmente caratterizzato nell’ambito cerebrovascolare alla fine degli anni ’70, quando si cercava di comprendere il danno post-ischemico [3].
Il “no reflow” cerebrale differisce da quello cardiaco a causa delle componenti microvascolari che sono esclusive del distretto cerebrale, come i piedi terminali degli astrociti o i periciti. Diversi meccanismi, che contribuiscono all’assenza di reflusso all’interno del circolo cerebrale, si estendono attraverso le arteriole precapillari, i capillari e le venule postcapillari [4].
Lo “swelling” postischemico nelle cellule endoteliali e nella parte terminale dei piedi degli astrociti determina una riduzione delle dimensioni del vaso entro un’ora dalla riperfusione [5].
Durante la riperfusione, le cellule endoteliali emettono contestualmente dei segnali fondamentali per facilitare la migrazione dei leucociti nei tessuti cerebrali e aumentare la permeabilità della barriera ematoencefalica. Inoltre, l’edema vasogenico, generatosi a seguito dell’evento ischemico, contribuisce ulteriormente al “gonfiore” all’interno dello spazio interstiziale [6]. Sono stati proposti alcuni modelli matematici che spiegherebbero come la compressione data potrebbe portare al collasso dei capillari cerebrali, contribuendo ulteriormente all’assenza di riflusso [7].
Per quanto riguarda i periciti, questi svolgono un ruolo fondamentale a livello dei capillari regolando il flusso sanguigno cerebrale [8]; infatti la loro degenerazione determinerebbe un disaccoppiamento dell’unità neurovascolare, privando il parenchima cerebrale di ossigeno [9]. Ovviamente anche lo stress ossidativo, con la liberazione di radicali liberi, partecipa sia alla disfunzione endoteliale sia alla morte dei periciti.
Possiamo concludere che al momento non è possibile stabilire la non inferiorità della MT diretta e pertanto la Bridging therapy risulta tutt’ora la migliore scelta terapeutica nel caso di stroke da LVO in circolo anteriore.
Serviranno ulteriori studi con un campione più ampio per poter identificare un’eventuale sottopopolazione di pazienti in cui la MT diretta possa rappresentare la scelta terapeutica più opportuna.
Dott. Stufano Gianluca Università degli Studi di Palermo
Bibliografia
- Berge E, Whiteley W, Audebert H, De Marchis GM, Fonseca AC, Padiglioni C, de la Ossa NP, Strbian D, Tsivgoulis G, Turc G. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke. Eur Stroke J. 2021 Mar;6(1):I-LXII. doi: 10.1177/2396987321989865. Epub 2021 Feb 19. PMID: 33817340; PMCID: PMC7995316.
- Turc G, Bhogal P, Fischer U, Khatri P, Lobotesis K, Mazighi M, Schellinger PD, Toni D, de Vries J, White P, Fiehler J. European Stroke Organisation (ESO) – European Society for Minimally Invasive Neurological Therapy (ESMINT) Guidelines on Mechanical Thrombectomy in Acute Ischaemic StrokeEndorsed by Stroke Alliance for Europe (SAFE). Eur Stroke J. 2019 Mar;4(1):6-12. doi: 10.1177/2396987319832140. Epub 2019 Feb 26. PMID: 31165090; PMCID: PMC6533858.
- Ames et al.; PMID:5635861.
- Robert A. Kloner et. al; doi:10.1152/ajpheart.00183.2018.
- Garcia JH, Liu KF, Yoshida Y, Chen S, Lian J. Brain microvessels: factors altering their patency after the occlusion of a middle cerebral artery (Wistar rat). Am J Pathol 145: 728–740, 1994.
- Granger DN, Kvietys PR. Reperfusion therapy: what’s with the obstructed, leaky and broken capillaries? Pathophysiology 24: 213–228, 2017. doi:10.1016/j.pathophys.2017.09.003.
- Mohamed Mokhtarudin MJ et al. doi:10.1016/j.mbs.2015.02.011.
- Hall CN, Reynell C, Gesslein B, Hamilton NB, Mishra A, Sutherland BA, O’Farrell FM, Buchan AM, Lauritzen M, Attwell D. Capillary pericytes regulate cerebral blood flow in health and disease. Nature 508: 55–60, 2014. doi:10.1038/nature13165.
- Kisler K, Nelson AR, Rege SV, Ramanathan A, Wang Y, Ahuja A, Lazic D, Tsai PS, Zhao Z, Zhou Y, Boas DA, Sakadžić S, Zlokovic BV. Pericyte degeneration leads to neurovascular uncoupling and limits oxygen supply to brain. Nat Neurosci20: 406–416, 2017. doi:10.1038/nn.4489.